
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
 .
.
分析 (1)Cl原子的核外电子排布式为1s22s22p63s23p5,有三层,离原子核越远的电子层其能量越高;
(2)①核外电子排布相同的离子,核电荷数越大,离子半径越小;
②该元素的第III电离能剧增,则该元素属于第IIA族;
(3)根据Cu的电子排布式书写Cu2+离子的电子排布式,注意原子形成离子先失去高能层中高能级电子;根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型和杂化方式;Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键;
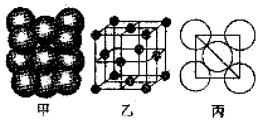
(4)根据晶胞结构知,该原子配位数=3×8÷2=12,根均摊法计算出该晶胞中原子个数4,根据晶胞密度=$\frac{M×4}{\frac{{N}_{A}}{V}}$计算.
解答 解:(1)Cl原子的核外电子排布式为1s22s22p63s23p5,有三层,离原子核越远的电子层其能量越高,故答案为:M;
(2)①核外电子排布相同,核电荷数越大,离子半径越小,锂的质子数为3,氢的质子数为1,Li+、H-核外电子数都为2,所以半径Li+<H-,
故答案为:<;
②该元素的第III电离能剧增,则该元素属于第IIA族,为Mg元素,
故答案为:Mg;
(3)铜晶体中铜原子堆积模型为面心立方最密堆积,Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,铜原子失去4s及3d上各一个电子形成Cu2+,故Cu2+离子的电子排布式为:1s22s22p63s23p63d9,SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,内界结构用示意图表示为 ,
,
故答案为:面心立方最密堆积;1s22s22p63s23p63d9;sp3; ;
;
(4)根据晶胞结构知,位于面心和顶点的距离最近,而每个顶点为12个面共有,则该原子配位数为12,或原子配位数=3×8÷2=12,晶胞棱长=$\frac{\sqrt{2}}{2}$×4d=2$\sqrt{2}$d,晶胞体积=(2$\sqrt{2}$d)3,该晶胞中原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞密度=$\frac{M×4}{\frac{{N}_{A}}{V}}$=$\frac{{M}_{r}}{4\sqrt{2}{d}^{3}{N}_{A}}$,
故答案为:12;$\frac{{M}_{r}}{4\sqrt{2}{d}^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,侧重考查学生的分析能力和计算能力,涉及核外电子排布、电离能、杂化方式的判断、晶胞的计算等知识点,难点是晶胞的计算,灵活运用公式是解本题关键,难度中等.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=-3 540 kJ•mol-1 | |
| B. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=-3 540 kJ•mol-1 | |
| C. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=+3 540 kJ•mol-1 | |
| D. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=+3 540 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
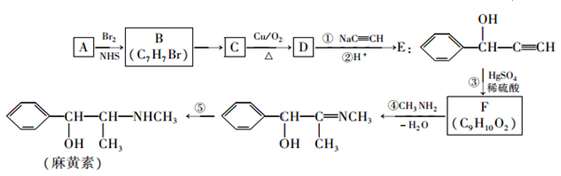
 ,E中含氧官能团的名称为羟基、碳碳三键.
,E中含氧官能团的名称为羟基、碳碳三键.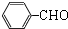 .
.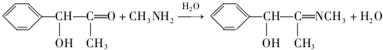 .
. (任写一种).F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是d(填字母).
(任写一种).F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是d(填字母).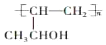 ,其他试剂任选.
,其他试剂任选.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 b.
b.
 d.
d.
 结构相似的醇不能被氧化为醛或酸.
结构相似的醇不能被氧化为醛或酸.
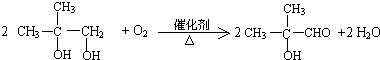 .
.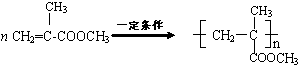 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (称为羟醛缩合反应)
(称为羟醛缩合反应)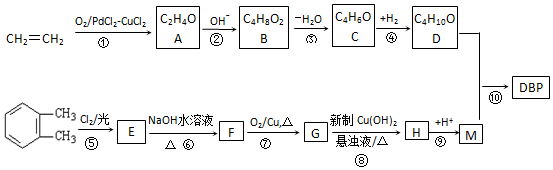
 .
. .
.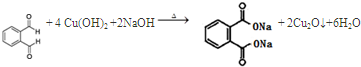 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 很早以前人们用加热胆矾或绿矾的方法制取硫酸 | |
| B. | 将氢气在氯气中燃烧生成氯化氢,然后溶于水得到盐酸,工业上常用此法制取盐酸 | |
| C. | 苏打是焙制糕点所用的发酵粉的主要成分之一,还可以用来治疗胃酸过多的一种药剂 | |
| D. | “水玻璃”是建筑行业中经常使用的一种黏合剂,同时也可用作防腐剂和防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2I-+Cl2═I2+2Cl- | |
| B. | 2Fe2++2Br-+2I-+3Cl2═2Fe3++I2+Br2+6Cl- | |
| C. | 2Fe2++4Br-+2I-+4Cl2═2Fe3++I2+2Br2+8Cl- | |
| D. | 4Fe2++2Br-+2I-+4Cl2═4Fe3++I2+Br2+8Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com