
分析 (1)钠与氧气常温下反应生成氧化钠,现象钠块表面由银白色变为暗灰色;
(2)依据钠熔化成一个小球可知反应放出热量,钠的熔点低;
(3)钠投入盛有饱和石灰水,钠与水反应生成氢氧化钠和氢气,反应放热,结合氢氧化钙溶解度随着温度升高而降低及钠的物理性质解答;
(4)依据钠能够与氧气、水蒸气反应,钠的密度大于煤油解答.
解答 解:(1)钠与氧气常温下反应生成氧化钠,方程式:4Na+O2═2Na2O,现象钠块表面由银白色变为暗灰色;
故答案为:钠块表面由银白色变为暗灰色;4Na+O2═2Na2O;
(2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是①钠与水反应放出热量,②钠的熔点低;
故答案为:钠与水反应放出热量; 钠的熔点低;
(3)①钠投入盛有饱和石灰水,钠与水反应生成氢氧化钠和氢气,反应放热,氢氧化钙溶解度随着温度升高而降低,所以看到现象为:钠熔化成小球并在液面上游动;有气泡产生;溶液变浑浊;看不到现象:烧杯底部有银白色的金属钙生成;
故选:C;
②钠与水反应生成氢氧化钠和氢气,方程式:2Na+2H2O═2NaOH+H2↑;
故答案为:2Na+2H2O═2NaOH+H2↑;
(4)钠能够与氧气、水蒸气反应,钠的密度大于煤油,钠放在煤油中能够隔绝氧气和水蒸气;
故答案为:防止钠与空气中的氧气和水蒸气接触.
点评 本题考查了元素化合物知识,侧重考查钠及钠与水的反应,明确钠的性质及钠与水反应产物是解题关键,注意氢氧化钙溶解度随着温度升高而降低特点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| … | E | A | B | ||
| C | … | D |
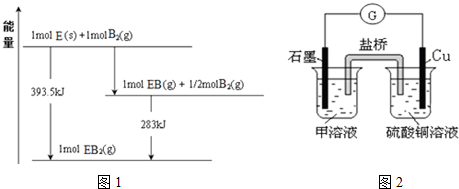
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某气体通入FeCl2溶液中 | 溶液由浅绿色变为黄色 | 该气体中一定含有Cl2 |
| B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体中一定含有SO2 |
| C | 将某气体通过灼热的CuO粉末 | 粉末由黑变红 | 该气体中一定含有H2 |
| D | 将某气体与湿润的红色石蕊试纸接触 | 试纸变蓝色 | 该气体中一定含有NH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 在 FeBr3的催化作用下可与溴水发生取代反应 | |
| B. | 该烃与足量 H2的加成产物一氯代物最多有四种 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇 | B. | 甲酸 | C. | 甲醛 | D. | 甲酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 mol KClO3参加反应,有2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
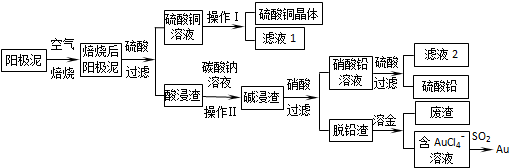
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com