
| A. | 标准状况下,2.24LH2O含有的分子数等于0.1NA | |
| B. | 0.5mol/L 的AlCl3溶液中含有的Al3+数为0.5 NA | |
| C. | 常温常压下16g O2中,氧原子数为NA | |
| D. | 1mol过氧化钠与水充分反应,转移的电子数为2NA |
分析 A、标况下水为液态;
B、溶液体积不明确;
C、氧气由氧原子构成;
D、过氧化钠和水的反应为歧化反应.
解答 解:A、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、溶液体积不明确,故溶液中的铝离子的个数无法计算,故B错误;
C、氧气由氧原子构成,故16g氧气中氧原子的物质的量为n=$\frac{16g}{16g/mol}$=1mol,个数为NA个,故C正确;
D、过氧化钠和水的反应为歧化反应:2Na2O2+2H2O=4NaOH+O2↑,此反应中,1mol过氧化钠转移1mol电子即NA个,故D错误.
故选C.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铱为非金属元素 | |
| B. | ${\;}_{77}^{192}$Ir中子数与质子数的差为38 | |
| C. | 铱元素与碘元素位于同一周期 | |
| D. | ${\;}_{77}^{192}$Ir核外含有115个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油的主要成分是高级脂肪酸 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 | |
| D. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池是一种将化学能转化为电能的装置 | |
| B. | 铁船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 工业上电解饱和食盐水的阴极反应:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,1mol氦气含有原子数为2NA | |
| B. | 0.5molO2和0.5molO3的混合物所含有的氧原子个数为2.5NA | |
| C. | 常温常压下,2.24 LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
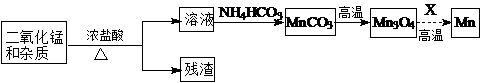
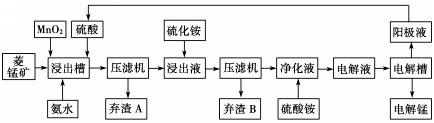
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.5 | 9.8 | 3.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
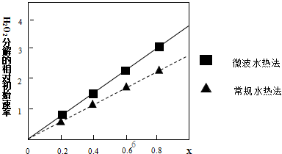
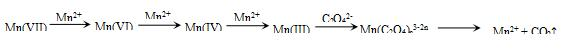
| 实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10 mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50 mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | \ | 18 |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/L K2SO4溶液 | 18 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ③④⑤ | C. | ③⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com