
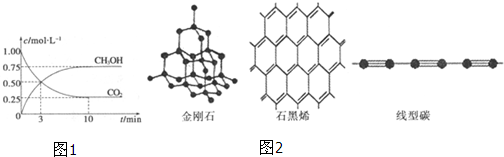
| △c |
| △t |
| 2.25mol/L |
| 10min |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 0.75×0.75 |
| 0.25×0.753 |


科目:高中化学 来源: 题型:
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
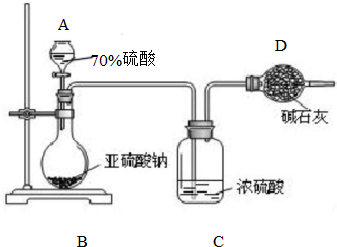 为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:
为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某有机物M的球棍模型如图所示:
某有机物M的球棍模型如图所示:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
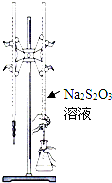 H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )
H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )| A、该滴定可用甲基橙做指示剂 |
| B、Na2S2O3是该反应的还原剂 |
| C、该滴定可选用如图所示装置 |
| D、该反应中每消耗2mol Na2S2O3,电子转移数为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
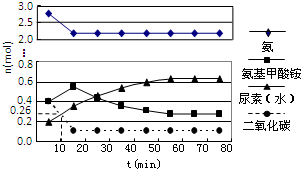 尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:查看答案和解析>>
科目:高中化学 来源: 题型:
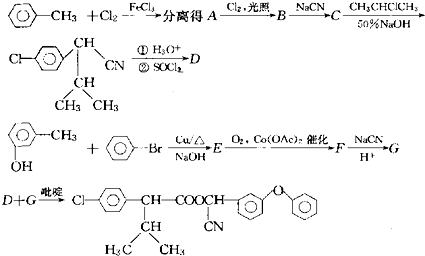
| ①H3O+ |
| ②SOCl2 |
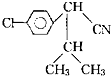
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com