
| A. | 该溶液可能由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成 | |
| B. | 该溶液可以由pH=3的CH3COOH溶液与PH=11的NaOH洛液等体积混合而成 | |
| C. | 该溶液中离子浓度的关系符合c(CH3COO-)+c (OH-)>c (Na+ )+c (H+ ) | |
| D. | 在上述溶液中加入适量NaOH,离子浓度大小可改变为:c(CH3COO-)>c (Na+ )>c (OH-)>c (H+ ) |
分析 离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),CH3COONa为强碱弱酸盐,其溶液呈碱性,混合溶液呈酸性,则溶液中的溶质是CH3COONa和CH3COOH,且醋酸电离程度大于醋酸根离子水解程度.
解答 解:A.0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,二者恰好反应生成CH3COONa,醋酸钠为强碱弱酸盐,其溶液呈碱性,而不是酸性,故A错误;
B.常温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液中,c(CH3COOH)>c(NaOH),二者等体积混合,醋酸过量,其溶液呈酸性,故B正确;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),故C错误;
D.加入少量NaOH溶液,如果溶液中存在c(OH-)>c(H+),根据电荷守恒得c(CH3COO-)<c(Na+),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,根据溶液酸碱性结合溶质的性质确定溶液中的溶质,再结合电荷守恒来分析解答,离子浓度大小比较常常与弱电解质的电离、盐类水解联合考查,确定离子浓度大小常常根据原子守恒、物料守恒及质子守恒解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 10 min内,Y的平均反应速率为0.03 mol•L-1•s-1 | |
| B. | 10 min内,X和Y反应放出的热量为a kJ | |
| C. | 10 min内,消耗0.2 mol X,生成0.4 mol Z | |
| D. | 10 min内,前5minX的平均反应速率与后5minX的平均反应速率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | |
| B. | 混合溶液的pH=7 | |
| C. | 混合溶液中c(H+)=$\sqrt{Kw}$ mol?L-1 | |
| D. | 向反应后的混合液中滴加石蕊试液后呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
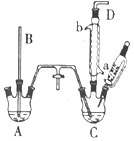 氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下: +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$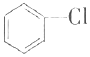 +HCl
+HCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 molNa2O2与足量的CO2充分反应转移的电子数为0.2NA | |
| B. | 常温常压下,18g H2O 所含的中子数为8NA | |
| C. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,有0.3NA个电子转移 | |
| D. | 将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法精炼铜时,可选择精铜做阳极,硫酸铜溶液为电解质溶液 | |
| B. | 煤油可由石油分馏获得,可用作燃料或保存少量金属钠 | |
| C. | 鲜榨的苹果汁在空气中极易被氧化,为防止其氧化可向其中加入维生素C.在这个过程中,维生素C发生了氧化反应 | |
| D. | 利用油脂在碱性条件下的水解,可制得肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CO32- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Na+、Ag+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:4 | C. | 3:4 | D. | 1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com