
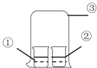
| ①中物质 | ②中物质 | 实验预测 | |
| A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
| B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
| C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
| D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓氨水具有挥发性,氨气溶于水形成氨水,氨水显示碱性;
B.浓硝酸具有挥发性和氧化性,能将碘离子氧化为碘单质;
C.浓盐酸具有挥发性和酸性,能和氨气之间发生反应,产生氯化铵固体;
D.饱和亚硫酸不稳定分解产生二氧化硫,二氧化硫能和溴水发生氧化还原反应生成硫酸和氢溴酸.
解答 解:A.浓氨水具有挥发性,氨气溶于水形成氨水,氨水显示碱性,使得酚酞溶液变为红色,现象与预测一致,故A不选;
B.浓硝酸具有挥发性和氧化性,能将碘离子氧化为碘单质,淀粉遇到单质碘显示蓝色,现象与预测一致,故B不选;
C.浓盐酸具有挥发性和酸性,能和氨气之间发生反应,产生氯化铵固体,大烧杯中有白烟,现象与预测一致,故C不选;
D.饱和亚硫酸不稳定分解产生二氧化硫,二氧化硫能和溴水发生氧化还原反应生成硫酸和氢溴酸,所以秀水的颜色会消失,现象与预测不一致,故D选.
点评 本题考查实验装置的综合及元素化合物性质,为高频考点,把握发生的反应及反应现象的关系为解答的关键,侧重分析与实验能力及综合应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用锌粒和稀硝酸反应制备H2 | B. | 用NH4NO3加热制取NH3 | ||
| C. | 大理石与稀硫酸反应制备CO2 | D. | 用焰色反应鉴别固体NaCl和 KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1FeCl3溶液中,Na+、NH4+、HCO3-、ClO-一定大量共存 | |
| B. | 常温下,某溶液中由水电离出的c(H+)=1×10-amol•L-1,则该溶液一定pH=a | |
| C. | 相同物质的量浓度下列溶液:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4;④NH3•H2O.其中c(NH4+)由大到小的顺序是①>②>③>④ | |
| D. | AgCl悬浊液中存在如下平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向其中加入少量NaCl晶体,平衡逆向移动,故AgCl溶解度减少,溶度积Ksp也减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
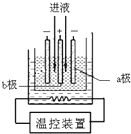 用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取 电解二氧化锰(EMD)的工艺流程如下:
用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取 电解二氧化锰(EMD)的工艺流程如下: Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s)
Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s) Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去.
Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com