
����Ŀ����Na2SO3��Һ�Ͳ�ͬ��������������Һ��Ϊʵ�����̽���ε����ʺ�����Һ�䷴Ӧ�Ķ����ԣ�
ʵ�� | �Լ� | ���� | |
�ι� | �Թ� | ||
| 0.2 molL��1 Na2SO3��Һ | ����Ag2SO4��Һ | ������ɫ���� |
0.2 molL��1 CuSO4 | ����Һ���̣������μӲ����ػ�ɫ���� | ||
0.1 molL��1 Al2��SO4��3��Һ | ��ʼ�����Ա仯�������μӲ�����ɫ���� | ||
��1�������飬������еİ�ɫ������Ag2SO3 �� �����ӷ���ʽ��������� ��
��2�������飬�������ػ�ɫ�����в���SO42�� �� ����Cu+��Cu2+��SO32�� ��
��֪��Cu+ ![]() Cu+Cu2+ �� Cu2+
Cu+Cu2+ �� Cu2+ ![]() CuI������ɫ��+I2 ��
CuI������ɫ��+I2 ��
����ϡ����֤ʵ�����к���Cu+��ʵ�������� ��
��ͨ������ʵ��֤ʵ�������к���Cu2+��SO32�� �� 
a����ɫ����A��BaSO4 �� �Լ�1�� ��
b��֤ʵ�����к���Cu2+��SO32���������� ��
��3����֪��Al2��SO3��3��ˮ��Һ�в����ڣ������飬�����İ�ɫ��������SO42�� �� �ð�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ��
���Ʋ�����к������������ ��
�ڶ��ڳ�������������Ĵ�����ʽ������ּ��裺i����Al��OH��3��������ii�����������ļ�ʽ���У��Լ���ii����˶Ա�ʵ�飬֤ʵ�˼���ii������
a�����Ա�ʵ�鷽������������
����һ�� 
�����������ͼ��ʽ���֣���
b������ii������ʵ��֤����
��4������ʵ�飬�������ε������� �� ����Һ�䷴Ӧ�Ķ��������йأ�
���𰸡�
��1��2Ag++SO32��=Ag2SO3��
��2��������ɫ���壻HCl��BaCl2��Һ����I���������£�Cu2+ת��Ϊ��ɫ����CuI��SO32��ת��ΪSO42��
��3��Al3+��OH����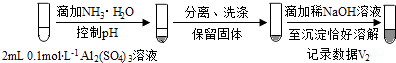 ��V1���Դ���V2
��V1���Դ���V2
��4���ܽ��ԡ���ԭ�ԡ���ˮ��Һ�гʼ��ԣ���������Һ�����������ӵ����ʺͷ�Ӧ����
���������⣺��1��ʵ�����0.2mol/LNa2SO3��Һ���뱥��Ag2SO4��Һ������Ag2SO4������Һ����Һ��Ϻ�ϡ�ͣ���˲�������Ag2SO4����������SO32��Ũ�Ƚϴ�����ƶϰ�ɫ����ΪAg2SO3 �� ��Ӧ�����ӷ���ʽΪ��2Ag++SO32��=Ag2SO3�����ʴ�Ϊ��2Ag++SO32��=Ag2SO3������2�������ݷ�ӦCu+��ϡ���ᷴӦͭ��ͭ���ӣ��������к���Cu+ �� ����ϡ����ᷢ���绯��Ӧ����ͭ���ʣ�ʵ���������к�ɫ�������ɣ��ʴ�Ϊ��������ɫ���壻��a������ʵ�����̿�֪ʵ��ԭ��Ϊ2Cu2++4I��=2CuI+I2��I2+SO32��+H2O=SO42��+2I��+2H+��SO42��+Ba2+=BaSO4��������BaSO4������֪��������Լ�Ϊ��Ba2+�Ļ��������ѡ��BaCl2��Һ�����dz���Aû��BaSO3 �� ���Ӧ�����Ի����У�
�ʴ�Ϊ��HCl��BaCl2��Һ��
b���ɰ�ɫ����A��֪֮ǰ��ȡ�ϲ���Һ����SO42�� �� �ɼ���KI���ɰ�ɫ������֪�ػ�ɫ�����к���Cu2+ �� Cu2+��I����������CuI��ɫ�������ɼӵ���������˵���ϲ���Һ����I2 �� ��Cu2+��I����Ӧ����I2 �� ����ƶ����ɵ�I2������������Ӧ������л�ԭ��SO32����
�ʴ�Ϊ���ػ�ɫ������KI��Һ��Ӧ���ɰ�ɫ������CuI����֤������Cu2+ �� ��ɫ����AΪ���ᱵ��֤������SO32������3���ٸ�������֪ʵ���İ�ɫ��������SO42�� �� �ð�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ�������Ʋ�����к���Al3+��OH�� �� ��ʹ����KMnO4��Һ��ɫ����Ϊ�����л�ԭ�Ե�����������ӣ�
�ʴ�Ϊ��Al3+��OH�����ڸ��ݼ����֪ʵ���Ŀ����֤�������ij�����Al��OH��3�������ļ�ʽ�Σ�����ʵ�������Ʊ���������еij�����Ȼ����õμ�NaOH��Һ����˶Ա�ʵ������Ҫ�Ʊ���Al��OH��3������Ȼ��μ�NaOH��Һ�����������ĵ�NaOH�����ͬ����������еij�������Al��OH��3���������������ĵ�NaOH�����ͬ����������еij������������ļ�ʽ�Σ�
���ļ�ʽ�κ�NaOH��Һ��Ӧ�൱�������Ӻ�NaOH��Ӧ����Ӧ����Ϊ1��4����Al��OH��3��NaOH��Ӧ����Ϊ1��1�������V1���Դ���V2 �� �����ii��������V1=V2 �� �����i������
�ʴ�Ϊ��a��  ��
��
b������ii������ʵ��֤����V1���Դ���V2 ��
�ʴ�Ϊ��V1���Դ���V2����4����Ŀ���жദ��ʾ���ǻ�ԭ�ԣ����磨3���еij�������ʹ���Ը��������ɫ���ڶ��գ�ʵ�����Ҫ����ʵ��Ŀ�ģ�������Ŀ������̽������ Na2SO3��Һ�Ͳ�ͬ��������������Һ��Ӧ�����Եõ����ۣ�����Һ�䷴Ӧ�Ķ���������������Һ�����������ӵ����ʺͷ�Ӧ�����йأ�
�ʴ�Ϊ����ԭ�ԡ�ˮ��ʼ��ԣ���������Һ�����������ӵ����ʺͷ�Ӧ�����йأ�
��1��0.2mol/LNa2SO3��Һ���뱥��Ag2SO4��Һ������Ӧ���ɰ�ɫ����Ag2SO3����2���ٸ��ݵڶ���������2����֪��Ϣ�����Ե�֪��ȡ����ϴ�����ų�Cu2+���ţ����ػ�ɫ�������μ�ϡ���ᣬ������죨ͭ���ʣ�����֤���� Cu+����a������BaSO4������֪��������Լ�Ϊ��Ba2+�Ļ��������ѡ��BaCl2��
b���ɰ�ɫ����A��֪֮ǰ��ȡ�ϲ���Һ����SO42�� �� �ɼ���KI���ɰ�ɫ������֪�ػ�ɫ�����к���Cu2+ �� Cu2+��I����������CuI��ɫ�������ɼӵ���������˵���ϲ���Һ����I2 �� ��Cu2+��I����Ӧ����I2 �� ����ƶ����ɵ�I2������������Ӧ������л�ԭ��SO32������3���������⣬��ɫ������������ǿ�ᣬ��������ǿ����Եõ������к���Al3+��OH�� �� ��ʹ����KMnO4��Һ��ɫ����Ϊ�����л�ԭ�Ե�����������ӣ��ڸ���ʵ��Ŀ�ĺͶԱ�ʵ�����ԭ�����н�𣻣�4������ʵ�飬�������ξ����ܽ��ԡ���ԭ�ԡ�ˮ��ʼ��ԣ�����Һ�䷴Ӧ�Ķ���������������Һ�����������ӵ����ʺͷ�Ӧ�����йأ�


 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й������ǵ�˵���������(����)
A.�����ǵķ���ʽΪC6H12O6
B.�������ܷ���������Ӧ
C.��������������Ҫ��������Դ
D.���������ڸ߷��ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����Ľ���Na��Mg��Al�ֱ���100mL 2mol/L����Һ��Ӧ��ʵ����������������V�����ۺ�Ϊ��״������ʱ��t�Ĺ�ϵ��ͼ��������˵��������ǣ������� 
A.��Ӧʱ��Na��Mg��Al������
B.x=2.24
C.�Ƶ����ʵ���Ϊ0.2 mol
D.����bΪMg�����ᷴӦ��ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ϡ��ķ��ֺ�ʹ�������Ἣ����ƶ�����������ķ�չ��һЩ���ϵij�������������̱�ʽ��ʱ�������壮��ش��������⣺
��1����ʯ�ޣ�CaMg3Si4O12���dz��õ��ͻ���ϣ������������ʽ��ʾ����� ��
��2����ij���ǻҵijɷ�Ϊ��
�� �� | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
�������� | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
ͨ����ͼ���̿��ɵ��ǻ��Ʊ��ϴ����Ķ������裮
��ش��������⣺
��������������ʽ��з��࣬���ǻ����漰��������������࣮
��3����������漰SiO2�����ӷ�Ӧ����ʽΪ ��
��4������A�ijɷ������ѧʽ��
��5�������ϴ�ӳ����ķ����ǣ�
��6������۷�Ӧ�Ļ�ѧ����ʽΪ����ʵ���ҽ��в�����õ������������������ƾ��ơ������Ǽܣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ˮ��Һ���ܴ����������
A. Cu2+��Na+��NO3-��OH- B. H+��K+��CO32-��Cl-
C. Mg2+��NH4+��OH-��SO42- D. Na+��Ca2+��NO3-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������һ�ֹ�ҵ��������Ҫ�ɷ�ΪMgCO3��Mg2SiO4������Fe��Al�������Ϊԭ���Ʊ�MgCO33H2O��ʵ�������ͼ1�� 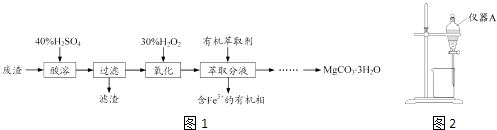
��1�����ܹ�������Ҫ��Ӧ���Ȼ�ѧ����ʽΪ
MgCO3��s��+2H+��aq���TMg2+��aq��+CO2��g��+H2O��l����H=��50.4kJmol��1
Mg2SiO4��s��+4H+��aq���T2Mg2+��aq��+H2SiO3��s��+H2O��l����H=��225.4kJmol��1
��������ȵ�Ŀ����_������H2SO4���˹���̫���ԭ���� ��
��2������H2O2����ʱ������Ӧ�����ӷ���ʽΪ
��3����ͼ2��ʾ��ʵ��װ�ý�����ȡ��Һ���Գ�ȥ��Һ�е�Fe3+ ��
��ʵ��װ��ͼ������A������Ϊ ��
��ΪʹFe3+�����ܶ�ش�ˮ��ת�����л��࣬��ȡ�IJ�������װ��ˮ��Һ������A�м���һ�������л���ȡ���������á���Һ�����ظ���Σ�
��4���벹����������ȡ��õ���ˮ��Һ�Ʊ�MgCO33H2O��ʵ�鷽�����߽��������Һ�еμӰ�ˮ�� �� ���ˡ���ˮϴ�ӹ���2��3�Σ���50���¸���õ�MgCO33H2O��
��֪����Һ��pH=8.5ʱMg��OH��2��ʼ������pH=5.0ʱAl��OH��3������ȫ]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п�����������SO2��CO2�ķ�����
A. ͨ�����ʯ��ˮB. ��ʪ�����ɫʯ����ֽ
C. ���Ȼ�����ҺD. ����ζ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ������ش��������⣺
��1��д��ԭ��������С�ĵڢ���Ԫ��ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ�� ��
��2��д��3p�������2��δ�ɶԵ��ӵ�Ԫ�صķ�����
��3��ijԪ�ر���ѧ�ҳ�֮Ϊ������Ԫ���еġ�����֮��������ԭ�ӵ���Χ�����Ų���4s24p4 �� ��Ԫ�ص���������
��4������VSEPRģ�ͣ�H3O+�Ŀռ乹��Ϊ�� �� ������ԭ�ӵ��ӻ�����Ϊ ��
��5���������ľ����ڲ�ͬ�¶��������ֶѻ���ʽ�������ֱ���ͼ��ʾ��������������������������������ʵ�ʺ��е�Feԭ�Ӹ���֮��Ϊ �� 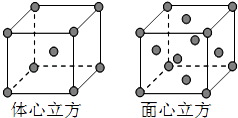
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����������ˮ�μӵ�һ����ɫʯ����ֽ�ϣ���ֽ�ϻ������ͼ��ʾ�İ뾶�����������������Բ������������ɫ��ͬ�������й�˵���в���ȷ���ǣ������� 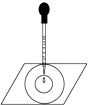
A.��ʵ�������ˮ�������ԡ�Ư����
B.�ڻ��ʰ�ɫ����ʺ�ɫ��dz��
C.�������ɫ�IJ��������ˮ�к���H+��HClO ������
D.���õ���ˮ�ε���ɫʯ����ֽ�ϣ��������������ͬ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com