
| A、用托盘天平称取11.7 g CuO粉末 |
| B、用广泛的pH试纸测得溶液的pH为6.2 |
| C、温度计显示的室温读数为25.69℃ |
| D、用100 mL量筒量取5.6 mL的稀硝酸 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 应称量NaOH的质量/g | 已给仪器 | 除已给仪器外还需要的其他仪器 |
| 烧杯、药匙、 托盘天平 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32.64 g |
| B、65.28 g |
| C、3.84 g |
| D、38.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
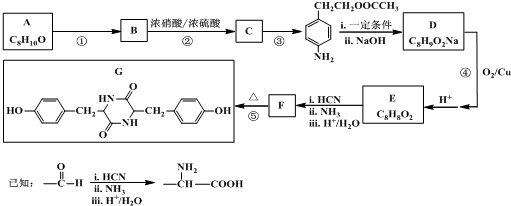
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有蓝色沉淀 |
| B、有蓝色沉淀和气体产生 |
| C、有气体产生,无沉淀生成 |
| D、无沉淀和有气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com