
下列离子反应方程式正确的是( )
A.向Na2SiO3溶液中逐滴加入少量稀盐酸:SiO32-+ 2H+=H2SiO3(胶体)
B.将Cu片加入稀硝酸中:Cu + 4H++2NO3-=Cu2+ +2NO2↑+ 2H2O
C.向Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+=SO42-+3S↓+H2O
D.向NH4Al(SO4) 2溶液中滴入Ba(OH)2恰好使SO42-反应完全:
2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定为1:1 | B. | 可能为2:3 | C. | 一定为3:2 | D. | 可能为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 纯净的H2在Cl2中燃烧 | 安静地燃烧,并发出苍白色火焰 | 说明燃烧不一定需要氧气参加 |
| B | 分别将蘸有浓氨水和浓硫酸的玻璃棒靠近 | 产生白烟 | NH3能和酸反应生成了相应的铵盐 |
| C | 把SO2通入高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色 | 说明SO2只具有漂白性 |
| D | 高温下,SiO2与纯碱混合加热,产生气体通入澄清石灰水 | 石灰水变浑浊 | 说明硅酸的酸性比碳酸强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将少量Fe(NO3)2试样加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 | 溶液变成血红色 | Fe(NO3)2试样已变质 |
| B | 向甲苯中滴加少量酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | 甲苯发生了氧化反应 |
| C | 常温下分别测定浓度均为0.1mol/L的Na2SiO3溶液和Na2CO3溶液的pH | pH:Na2SiO3>Na2CO3 | 非金属性:Si>C |
| D | 将少量某无色气体通入澄清石灰水中 | 出现白色沉淀 | 该气体一定是CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上10月月考化学试卷(解析版) 题型:填空题
物质的化学变化乍看起来,好像十分复杂,难以把握,而实际上是有规律可循的。认识化学原理并将化学原理应用于实际正是化学的魅力所在。
I.在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示
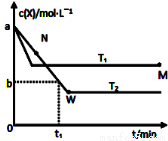
①该反应的化学平衡常数表达式为:_____________
②M点的正反应速率v正_________(填“>”、“=”或“<”)N点的逆反应速率v逆;T2下,在0~t1时间内,v(Y)=_______________;该反应进行到M点放出的热量_________(填“>”、“=”或“<”)进行到W点放出的热量。
③M点时再加入一定量的X,平衡后X的转化率___________(填“增大”、“减小”或“不变”)
II.0.1mol/LNaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中离子浓度由大到小的顺序为_________________
III.下图是某种燃料电池原理示意图:
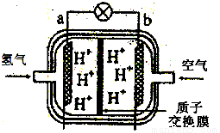
(1)该燃料电池工作过程中,其正极反应式为:________________________。
(2)若用此燃料电池作为电源向铁制品上镀上一层铜,则铁制品要连接在燃料电池的__________极(填“a”或“b”)上.若用此燃料电池电解精炼银,应使粗银作电解池的____________极,使用AgNO3和HNO3的混合溶液作电解液,若阴极有少量红棕色气体生成,则生成该气体的电极反应式为:__________________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次教学诊断化学卷(解析版) 题型:实验题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合在空气中充分焙烧。
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A。
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B。
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5。
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体。
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
① FeO•Cr2O3 + Na2CO3 + □ = Na2CrO4 + Fe2O3 + CO2↑
② Na2CO3+Al2O3=2NaAlO2+CO2↑
(2)固体A中主要含有 (填写化学式)。
(3)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
获得K2Cr2O7晶体的操作由多步组成,依次是:加入KCl固体、 、过滤、洗涤、干燥得到晶体。洗涤沉淀的操作为 。
(4)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量 (填写试剂名称)、溶解、过滤、再通入过量的CO2、灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池是
A.正极为Cu,负极为Fe,电解质溶液为FeCl3
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3
C.正极为Fe,负极为Zn,电解质溶液为Fe2(S O4)3
O4)3
D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
有K2SO4和Fe2(SO4)3的混合溶液,含Fe3+的物质的量浓度为0.1mol/L,而SO42﹣的物质的量浓度为0.3mol/L,则混合溶液中K+的物质的量浓度为( )
A.0.15mol/L B.0.3mol/L C.0.45mol/L D.0.6mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com