
| A、溴水 |
| B、品红溶液 |
| C、酸性高锰酸钾溶液 |
| D、滴入酚酞的氢氧化钠溶液 |


科目:高中化学 来源: 题型:
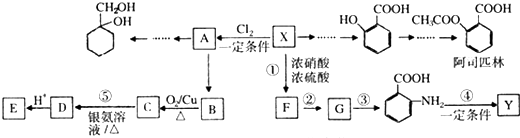
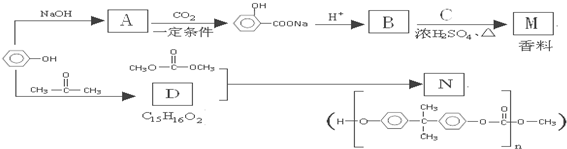
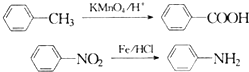 (苯胺,易被氧化)
(苯胺,易被氧化)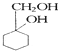 的流程图:
的流程图: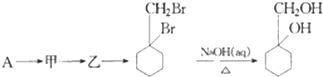
 多一个碳原子的同系物M有多种同分异构体,同时符合下列4个条件的M同分异构体有
多一个碳原子的同系物M有多种同分异构体,同时符合下列4个条件的M同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、⑤ | C、②③④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小苏打用于焙制糕点 |
| B、碳酸钙可用作补钙剂 |
| C、烧碱用于改良酸性土壤 |
| D、盐酸可用于清除铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y、W元素氧化物对应的水化物一定是强酸 |
| B、R元素位于第二周期第VA族 |
| C、稳定性:Z氢化物>W氢化物 |
| D、原子半径从小到大:Z<X<Y<R |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时,化学平衡常数K=1.8 |
| B、平衡时,N2O4的转化率为60% |
| C、前2s,N2O4的平均反应速率为0.005mol?L-1?s-1 |
| D、在2s时,体系内压强为反应前的1.1倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com