
| A、加入铝粉有氢气生成的溶液中:Mg2+、Cu2-、SO42-、K+ |
| B、使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- |
| C、c(Fe3+)=0.1mol/L的溶液中:Na+、SCN-、S2-、SO32- |
| D、无色溶液中:K+、Na+、HCO3-、Ca2+ |


科目:高中化学 来源: 题型:
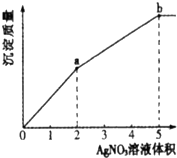 往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法正确的是( )
往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法正确的是( )| A、KSP(AgCl)<KSP(AgI) |
| B、c( Cl-):c( I-)=3:2 |
| C、m( AgCl ):m( AgI )=2:3 |
| D、a~b段产生黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙 |
| 乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a电极反应式:SO2+2H2O-2e-═SO42-+4H+ |
| B、b极与电源的正极相连 |
| C、离子交换膜c为阳离子交换膜 |
| D、气体W为氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 理由 | 结论 |
| A | 共价键强弱:O-H>S-H | 沸点:H2O>H2S |
| B | 元素的非金属性:Cl>S | 酸性:HCl>H2S |
| C | 相同外界条件下反应速率:a反应>b反应 | 活化能:b反应>a反应 |
| D | 还原性:Fe>Cu | 氧化性:Fe3+>Cu2- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S2O3 |
| B、FeCl3 |
| C、NaHCO3 |
| D、CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com