
【题目】下列关于Na和Na+的叙述中,错误的是( )
A. 它们相差一个电子层 B. 钠原子、钠离子均为同一元素
C. 它们的化学性质相似 D. 灼烧时,它们的焰色反应都呈黄色
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )
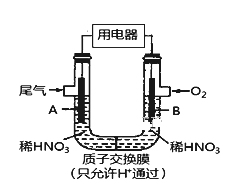
A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液.只用一种试剂就能加以区别,这种试剂是
A. KSCN B. BaCl2 C. NaOH D. HCI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为______________。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) ![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是____(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是____。
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1molCO2生成的同时有3mol H-H键断裂
(2)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是____________。
(3)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) 其平衡常数表达式为_____________________________。
CH4(g)+2H2O(g) 其平衡常数表达式为_____________________________。
向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,300℃时发生上述反应,达到平衡时各物质的浓度分别为:CO2:0.2 mol·L一1,H2:0.8 mol·L一1,CH4:0.8 mol·L一1,
H2O:1.6 mol·L一1。
则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=___________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____ O (填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验原理或操作的叙述中,正确的是( )
A.振荡分液漏斗后,应立即将漏斗放在铁架台的铁圈上静置
B.硝酸钾中含有少量氯化钠可用重结晶的方法提纯
C.点样后应在滤纸上形成一个直径较大的样斑,以便实验时观察
D.若不慎将液溴溅到手上,可立即用大量氢氧化钠溶液清洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被HNO3溶解,反应方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(1)请将上述反应改成离子方程式
(2)上述反应中,氧化剂是 , 氧化产物是 .
(3)每2molCu参加反应,转移的电子个,在反应的硝酸中没有参加氧化还原反应的硝酸占总硝酸的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色的化学
B.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉
C.电镀时,将镀件作为阳极
D.瑞典化学家贝采利乌斯最早提出了有机化学的概念
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列方法测定某水样中O2的含量。
(1)实验原理。
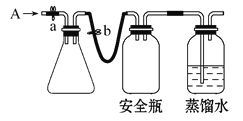
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为____________________________。
②在酸性条件下,再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为____________________。然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为I2+2Na2S2O32NaI+Na2S4O6。
(2)实验步骤。
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是_________;
②用注射器抽取某水样20.00 mL从A处注入锥形瓶;
③再分别从A处注入含mmol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及一定浓度的硫酸(含H2SO4nmol);
⑥重复④的操作;
⑦取下锥形瓶,向其中加入2~3滴__________作指示剂;
⑧用0.005 mol·L-1Na2S2O3溶液滴定至终点。滴定终点的现象是_____________。
(3)数据分析。
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________mg·L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将__________(填“偏大”“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.标准状况下,22.4 L H2O含有的分子数为1 NA
B.常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,1 NA 个CO2分子占有的体积为22.4 L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣ 个数为1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com