
下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
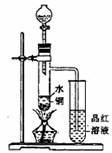
①一般认为1:1的硫酸浓度大于60%,就具有一定的氧化性,越浓氧化性越强,60%以下的H2SO4氧化性就不怎么强了。
②温度也影响氧化性,如铜放于冷的浓硫酸中反应不明显,如果加热就可以观察到明显现象。
③98%的浓硫酸物质的量浓度为18.4mol?L-1,密度为1.84g?cm-3据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓硫酸10―15滴(约0.5mL),加热至沸腾,该试管中液体是否有明显变化 _____。试用数据解释原因_________________________________。
(2)甲同学再用分液漏斗加浓硫酸10mL再加热至沸腾,现象是_____________________
__________________________。
(3)乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应。所观察到与甲不同的现象是______ ___________________原因是___________ _________________。为了最终看到与甲类似的现象,乙同学需进行的操作是_______________________________________。
(4)乙同学进行加热,还在带支管的试管中观察到有黑色物质出现,大胆假设此物质是_______________。
 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2014届江西省赣州市高三上学期期中考试化学试卷(解析版) 题型:实验题
(12分)某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)SO2气体与Fe3+反应的主要产物是__ __ 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是 。
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,写出有关离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省南昌市高三第三次模拟考试理综化学试卷(解析版) 题型:实验题
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)SO2气体与Fe3+反应的主要产物是____、 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是 。
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,写出有关离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
①一般认为1:1的硫酸浓度大于60%,就具有一定的氧化性,越浓氧化性越强,60%以下的H2SO4氧化性就不怎么强了。
②温度也影响氧化性,如铜放于冷的浓硫酸中反应不明显,如果加热就可以观察到明显现象。
③98%的浓硫酸物质的量浓度为18.4mol?L-1,密度为1.84g?cm-3
据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓硫酸10―15滴(约0.5mL),加热至沸腾,该试管中液体是否有明显变化 。(填“是”或“否”)
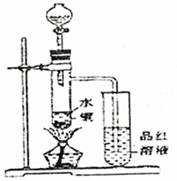
(2)甲同学再用分液漏斗加浓硫酸10mL后加热至沸腾,现象是 。
(3)乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应。所观察到与甲不同的现象是 。为了最终看到与甲类似的现象,乙同学需进行的操作是: 。
(4)乙同学进行加热,还在带支管的试管中观察到有黑色物质出现,大胆假设此物质是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com