
| 实验操作 | 预期现象与结论 |
| 现象: 结论: | |
| 实验操作 | 预期现象与结论 |
| 取两支试管,各加入3mL0.01mol/L KMnO4,1mL0.1mol/LH2SO4 | 现象:2mol/LH2C2O4溶液的KMnO4溶液褪色更快 结论:反应物浓度越大,化学反应速率越快 |
| 将一支试管中加入0.2mol/LH2C2O4溶液2mL,记录溶液褪色的时间 | |
| 将另一支试管中加入0.1mol/LH2C2O4溶液2mL,记录溶液褪色的时间 |


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
| A、若溶液中有Fe3+,则一定有Cu析出 |
| B、若溶液中只含Fe2+、Cu2+,则固体可能存在 |
| C、若有固体析出,则溶液中一定没有Cu2+ |
| D、若溶液中只有Fe2+,则固体一定只含Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐--③④ |
| B、混合物--②③⑥ |
| C、碱--④⑤ |
| D、纯净物--④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
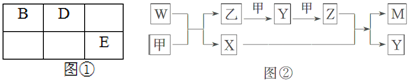
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL | B、5mL |
| C、大于5mL | D、小于5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
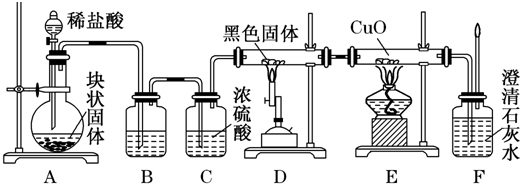
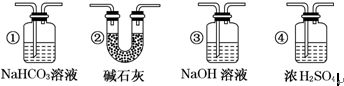
查看答案和解析>>
科目:高中化学 来源: 题型:

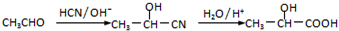
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com