
| A、甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ | ||
| B、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| C、含大量Al3+的溶液中:K+、Na+、NO3-、ClO- | ||
D、
|


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| A、点燃→通入澄清石灰水→加入溴的四氯化碳溶液 |
| B、点燃→罩上小烧杯→加入澄清石灰水 |
| C、点燃→通入澄清石灰水 |
| D、点燃→通入酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤 |
| B、用乙醇萃取碘水中的碘 |
| C、用溶解过滤蒸发的方法除去固体BaCl2中的BaSO4 |
| D、提纯含有少量硝酸钡杂质的硝酸钾溶液,加入过量硫酸钾溶液,过滤,滤液中补加适量硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO2-4反应完全:2Ba2++4OH-+Al3++2SO42-═2BaBO4↓+[Al(OH)4]- |
| C、向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO-3+4OH-═Mg(OH)2↓+2CO2-3+2H2O |
| D、向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO-3═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取ag混合物与足量的稀盐酸充分反应,将反应后的固体加热蒸干、灼烧得到bg固体 |
| B、取ag混合物与足量的稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg |
| C、取ag混合物与足量的BaCl2溶液充分反应,过滤、洗涤、烘干得到bg固体 |
| D、取ag混合物与足量的水反应,加热,使气体完全逸出,冷却至室温测得气体体积为VL(标况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列各组物质中,气体X和气体Y在通常条件下同时通入盛有溶液z的洗气瓶中(如图所示),可能没有沉淀生成的是( )
下列各组物质中,气体X和气体Y在通常条件下同时通入盛有溶液z的洗气瓶中(如图所示),可能没有沉淀生成的是( )| X | Y | Z | |
| A | NO2 | SO2 | BaCl2 |
| B | NH3 | O2 | Al2(SO4)3 |
| C | NH3 | HCl | AgNO3 |
| D | HCl | CO2 | CaCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3的分解率为20% |
| B、平衡时,v(O2)=0.005 mol/(L?min) |
| C、容器内气体的密度为40g/L |
| D、加压,容器内固体质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
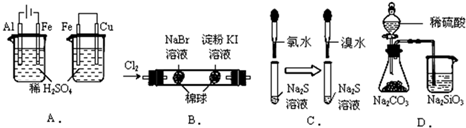
| A、实验现象:左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 实验结论:活动性:Al>Fe>Cu |
| B、实验现象:左边棉花变为橙色,右边棉花变为蓝色 实验结论:氧化性:Cl2>Br2>Ⅰ2 |
| C、实验现象:左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 实验结论:氧化性:Cl2>Br2>S |
| D、实验现象:锥形瓶中有气体产生,烧杯中液体变浑浊 实验结论:非金属性:S>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液比弱电解质溶液的导电能力强 |
| B、电解质一定是化合物 |
| C、SO3 溶于水形成的溶液能导电,所以SO3 是电解质 |
| D、NaCl固体不导电,所以NaCl不是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com