
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图的装置制备乙酸乙酯。
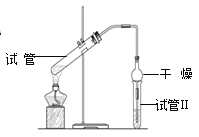
A.与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:____________
B.按正确操作实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物。现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。
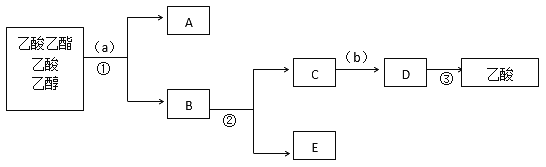
(1)写出加入的试剂(a)是________________;试剂(b)是_______________。
(2)写出有关的操作分离方法:
①是____________,②是______________,③是_________________。
(3)在得到的A中加入生石灰,振荡,目的是_________________________。
【答案】 防止倒吸 饱和碳酸钠溶液 浓度较大的硫酸 分液 蒸馏 蒸馏 除去乙酸乙酯中混有的少量水
【解析】A.球形干燥管容积较大,使乙酸乙酯充分与空气进行热交换,起到冷凝的作用,也可起到防止倒吸的作用;(1)加入的试剂(a)是饱和碳酸钠溶液,以溶解过量乙醇,中和过量乙酸,减少乙酸乙酯的溶解,使乙酸乙酯分离为A;试剂(b)是浓度较大的硫酸,将乙酸钠转化为乙酸;(2)分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出;分离方法②是蒸馏,利用乙醇的沸点较低,将乙酸钠和乙醇混合物中的乙醇分离为E,C为乙酸钠水溶液,加入浓度较大的硫酸生成乙酸,再进行分离方法③是蒸馏,将乙酸蒸出;(3)在得到的A中加入生石灰,振荡,目的是除去乙酸乙酯中混有的少量水。


科目:高中化学 来源: 题型:
【题目】工业上可利用下图所示电解装置吸收和转化SO2(A、B均为惰性电极)。下列说法正确的是
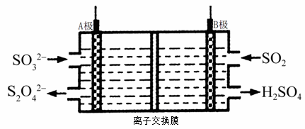
A.A电极接电源的正极
B.A极区溶液的碱性逐渐增强
C.本装置中使用的是阴离子交换膜
D.B极的电极反应式为SO2+2e-+2H2O == SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水是用适量氯气杀菌消毒过的.不法商贩常用自来水冒充纯净水谋取暴利,可用化学试剂鉴别真伪,该试剂可以是( )
A.酚酞试液
B.氯化钡溶液
C.氢氧化钠溶液
D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池、电解池和电化学腐蚀的说法正确的是( )
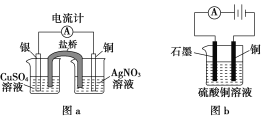

A.图a是原电池,可以实现化学能转化为电能
B.图b电解一段时间后,加入适量CuO固体,可以使硫酸铜溶液恢复到原浓度
C.图c装置可以防止铁钉生锈
D.图d在轮船铁质外壳上镶嵌锡块,可减缓船体的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】放热的氧化还原反应能设计成原电池.下列反应中能设计成原电池的是( )
A.Ba(OH)28H2O与NH4Cl反应
B.酸碱中和反应
C.灼热的炭与CO2反应
D.H2与Cl2的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。

(1)图中甲池是________装置(填“电解池”或“原电池”),其中OH-移向________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:____________________。
(3)向乙池两电极附近分别滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的反应式:________________。
(4)乙池中总反应的离子方程式:________________________。
(5)常温下,当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是________(若此时乙池中溶液的体积为500 mL);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是________(填序号)。
a.MgSO4 B.CuSO4
c.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知Zn+CuSO4=Cu+ZnSO4,设计成原电池,构造如图所示,试问CuSO4溶液放在 (填“甲”或“乙”)烧杯,盐桥中的Cl-移向 (填“甲”或“乙”)烧杯;
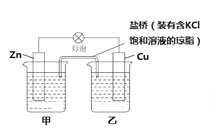
(2)已知①C(s)+ O2(g ) = CO2(g) ΔH=-393.5kJ/mol
②CO(g)+ ![]() O2(g) = CO2(g) ΔH=-283.0kJ/mol
O2(g) = CO2(g) ΔH=-283.0kJ/mol
请写出C转化为CO的热化学方程式: 。
(3)电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”。在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式 ,其中右图是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息(通电以后Na+的移动方向)判断电极2的名称是 ,并写出电极1的电极反应式 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A. 放电时负极反应为:Zn-2e-+2OH-===Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-===FeO42-+4H2O
C. 充电时,蓄电池的负极应与外接电源正极相连
D. 放电时负极附近溶液的碱性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com