
”¾ĢāÄæ”潫3mol/L NaOHČÜŅŗµĪČėµ½25mL Ņ»¶ØÅØ¶ČµÄAlCl3ČÜŅŗÖŠ”£ĻĀĶ¼ŹĒÕūøö¹ż³ĢµÄŹżŃ§·ÖĪöĒśĻß”£ĘäÖŠŗįÖį±ķŹ¾¼ÓČėOH-µÄĪļÖŹµÄĮæ£¬×ŻÖį±ķŹ¾²śÉśµÄAl(OH)3³ĮµķµÄĪļÖŹµÄĮ攣é§Ķ¼»Ų“š£ŗ
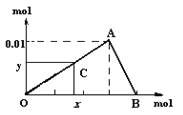
£Ø1£©µ±Cµć“ÓOµćĻņAµćŌĖ¶ÆŹ±£¬±ķŹ¾ĖęOH-µÄ²»¶Ļ¼ÓČė£¬³ĮµķĮæÖš½„________”£OAĒśĻß±ķŹ¾µÄĄė×Ó·“Ó¦ŹĒ________________£¬ÓÉ“ĖæɵĆAµćµÄ×ų±źĪŖ_______£»
£Ø2£©µ±Cµć“ÓAµćĻņBµćŌĖ¶ÆŹ±£¬±ķŹ¾£ŗ_____”£ABĒśĻß±ķŹ¾µÄĄė×Ó·“Ó¦ĪŖ£ŗ______£¬ÓÉ“ĖæɵĆBµćµÄ×ų±źĪŖ£ŗ__________”£
£Ø3£©ÓÉÉĻŹö·ÖĪö£¬æÉĒóµĆAlCl3ČÜŅŗÖŠAl3+Ąė×ÓµÄÅضČĪŖ£ŗ_____mol/L”£
”¾“š°ø”æŌö“ó Al3+ + 3OH”Ŗ = Al(OH)3”ż £Ø0.03£¬0.01£© Ėę×ÅOH”ŖµÄ²»¶Ļ¼ÓČė£¬³ĮµķµÄĮæ²»¶Ļ¼õÉŁ Al(OH)3 + OH- = AlO2- + 2H2O (0.04£¬0) 0.4
”¾½āĪö”æ
øł¾ŻĶ¼Ļń£¬µ±Cµć“ÓOµćĻņAµćŌĖ¶ÆŹ±£¬±ķŹ¾Ėę×ÅOH-µÄ²»¶Ļ¼ÓČė£¬³ĮµķĮæÖš½„Ōö¼Ó£¬AµćAl3+øÕŗĆĶźČ«³Įµķ£¬³ĮµķĮæ“ļ×ī“óÖµ£»“ÓAµćµ½Bµć£¬Ėę×ÅOH-µÄ²»¶Ļ¼ÓČė£¬³ĮµķĮæÖš½„¼õÉŁ£¬BµćŹ±Al(OH)3øÕŗĆĶźČ«Čܽā”£øł¾Ż×Ż×ų±źn[Al(OH)3]max=0.01molŗĶAlŹŲŗć£¬Ōn£ØAlCl3£©=0.01mol”£
£Ø1£©µ±Cµć“ÓOµćĻņAµćŌĖ¶ÆŹ±£¬±ķŹ¾Ėę×ÅOH-µÄ²»¶Ļ¼ÓČė£¬³ĮµķĮæÖš½„Ōö¼Ó£¬OAĒśĻß±ķŹ¾µÄĄė×Ó·“Ó¦ŹĒ£ŗAl3++3OH-= Al(OH)3”ż£¬ŌņAµćĻūŗĵÄn£ØOH-£©=3![]() 0.01mol=0.03mol£¬ÓÉ“ĖæɵĆAµćµÄ×ų±źĪŖ£Ø0.03£¬0.01£©£»
0.01mol=0.03mol£¬ÓÉ“ĖæɵĆAµćµÄ×ų±źĪŖ£Ø0.03£¬0.01£©£»
£Ø2£©µ±Cµć“ÓAµćĻņBµćŌĖ¶ÆŹ±£¬±ķŹ¾£ŗĖę×ÅOH”ŖµÄ²»¶Ļ¼ÓČė£¬³ĮµķµÄĮæ²»¶Ļ¼õÉŁ£»ABĒśĻß±ķŹ¾Al(OH)3ČÜÓŚNaOH£¬±ķŹ¾µÄĄė×Ó·“Ó¦ĪŖAl(OH)3 + OH- = AlO2- + 2H2O”£Čܽā0.01mol Al(OH)3ĻūŗÄn£ØOH-£©=0.01mol£¬ŌņBµćµÄ×ų±źĪŖ£Ø0.04£¬0£©£»
£Ø3£©Ōn£ØAlCl3£©=0.01mol£¬c£ØAlCl3£©=![]() =0.4mol/L£¬AlCl3ČÜŅŗÖŠAl3+Ąė×ÓµÄÅضČĪŖ0.4mol/L”£
=0.4mol/L£¬AlCl3ČÜŅŗÖŠAl3+Ąė×ÓµÄÅضČĪŖ0.4mol/L”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĶ¬Ń§ÓĆĶŠÅĢĢģĘ½³ĘĮæÉÕ±µÄÖŹĮ棬ĢģĘ½Ę½ŗāŗóµÄדĢ¬ČēĶ¼£®ÓÉĶ¼ÖŠæÉŅŌ擳ö£¬øĆĶ¬Ń§ŌŚ²Ł×÷Ź±µÄŅ»øö“ķĪóŹĒ______________£¬ÉÕ±µÄŹµ¼ŹÖŹĮæĪŖ___________g£®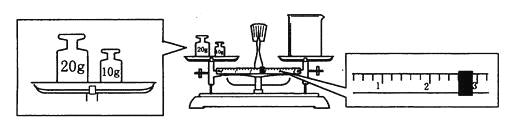
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆ¾ÄÜŌŚ¶žŃõ»ÆĢ¼ÖŠČ¼ÉÕ£ŗ2Mg£«CO2![]() 2MgO£«C£¬ÄʱČĆ¾øü»īĘĆ£¬ÄĒĆ“ÄĘÄÜŌŚ¶žŃõ»ÆĢ¼ÖŠČ¼ÉÕĀš£æÄ³ŃŠ¾æŠŌѧĻ°Š”×éÉč¼ĘĮĖČēĶ¼×°ÖĆ½ųŠŠĢ½¾æ”£
2MgO£«C£¬ÄʱČĆ¾øü»īĘĆ£¬ÄĒĆ“ÄĘÄÜŌŚ¶žŃõ»ÆĢ¼ÖŠČ¼ÉÕĀš£æÄ³ŃŠ¾æŠŌѧĻ°Š”×éÉč¼ĘĮĖČēĶ¼×°ÖĆ½ųŠŠĢ½¾æ”£
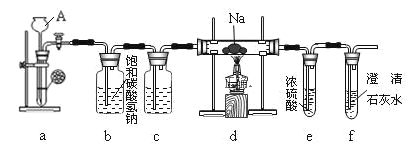
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©×°ÖĆaÖŠ·¢ÉśµÄŹĒŹµŃéŹŅÖĘCO2µÄ·“Ó¦£¬·“Ó¦·½³ĢŹ½ĪŖ___”£
£Ø2£©×°ÖĆbÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ___£¬×°ÖĆcµÄ×÷ÓĆĪŖ___”£
£Ø3£©ŹµŃé¹ż³ĢÖŠ£¬ŌŚµćČ¼d×°ÖĆÖŠµÄ¾Ę¾«µĘĒ°£¬±ŲŠė¾¹ż±ŲŅŖµÄ²Ł×÷·½æɽųŠŠŗóŠųµÄŹµŃ飬øƱŲŅŖµÄ²Ł×÷ŹĒ___”£
£Ø4£©ŹµŃé·¢ĻÖÄĘŌŚ³äĀś¶žŃõ»ÆĢ¼ĘųĢåµÄ²£Į§¹ÜĄļ¾ēĮŅµŲČ¼ÉÕ£¬²śÉś“óĮæµÄ°×ŃĢ²¢°éÓŠŗŚÉ«ĪļÖŹÉś³É”£Č”Ņ»²æ·ÖÉś³ÉĪļÓŚŹŌ¹ÜÖŠ£¬ĶłŹŌ¹ÜÖŠ¼ÓĖ®£¬°×É«ĪļÖŹČܽāÓŚĖ®£¬ŗŚÉ«ĪļÖŹ²»ČÜ”£¹żĀĖ£¬µĆµ½³ĪĒåµÄĀĖŅŗ”£ĶłĖłµĆĀĖŅŗÖŠ¼Ó³ĪĒåŹÆ»ŅĖ®£¬ČÜŅŗ±ä»ė×Ē”£ŌŁµĪČėĻ”ŃĪĖį£¬ ČÜŅŗÖŠÓŠĘųÅŻ³öĻÖ”£ŹŌŠ“³öÄĘÓė¶žŃõ»ÆĢ¼·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµāÕōĘųµÄ“ęŌŚÄܓ󷳶ČĢįøßN2OµÄ·Ö½āĖŁĀŹ£¬·“Ó¦Ąś³ĢĪŖ£ŗ
µŚŅ»²½I2(g)![]() 2I(g)£ØæģĖŁĘ½ŗā£©
2I(g)£ØæģĖŁĘ½ŗā£©
µŚ¶ž²½I(g)+N2O(g)”śN2(g)+IO(g)£ØĀż·“Ó¦£©
µŚČż²½IO(g)+N2O(g)”śN2(g)+O2(g)+I2(g)£Øæģ·“Ó¦£©
ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø £©
A.ÉżøßĪĀ¶Č£¬µŚŅ»²½ĻņÓŅ½ųŠŠµÄ³Ģ¶Č±ä“ó
B.µŚ¶ž²½µÄ»ī»ÆÄÜ“óÓŚµŚČż²½µÄ»ī»ÆÄÜ
C.×Ü·“Ó¦ĪŖ2N2O![]() 2N2+O2
2N2+O2
D.c[IO(g)]¶Ō×Ü·“Ó¦ĖŁĀŹµÄÓ°Ļģ“óÓŚc[I(g)]
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅæÉÓĆKMnO4ŗĶÅØŃĪĖį·“Ó¦ÖĘČ”ĀČĘų”£
KMnO4£«HCl£ØÅØ£©=KCl£«MnCl2£«Cl2”ü£«H2O£ØĪ“ÅäĘ½£©
£Ø1£©ÅäĘ½»Æѧ·½³ĢŹ½£¬²¢ÓƵ„ĻßĒűź³öµē×Ó×ŖŅʵķ½ĻņŗĶŹżÄ攣
£Ø2£©½«ÉĻŹöÅäĘ½µÄ»Æѧ·½³ĢŹ½øÄŠ“ĪŖĄė×Ó·½³ĢŹ½ ”£
£Ø3£©ÅØŃĪĖįŌŚ·“Ó¦ÖŠĻŌŹ¾³öĄ“µÄŠŌÖŹŹĒ________________
¢ŁÖ»ÓŠ»¹ŌŠŌ ¢Ś»¹ŌŠŌŗĶĖįŠŌ
¢ŪÖ»ÓŠŃõ»ÆŠŌ ¢ÜŃõ»ÆŠŌŗĶĖįŠŌ
£Ø4£©Čō²śÉś0.5molCl2£¬Ōņ±»Ńõ»ÆµÄHCl mol£¬×ŖŅʵĵē×ӵďżÄæŌ¼ĪŖ___________”£
£Ø5£©Ņ»¶ØĢõ¼žĻĀ£¬KMnO4»¹æÉŅŌŃõ»ÆĘäĖū»¹ŌŠŌĪļÖŹ”£
MnO4£+C2O42£+ = Mn2+ +CO2”ü+
Ķź³ÉÉĻŹöĄė×Ó·½³ĢŹ½£¬“Ė·“Ó¦ÖŠ£¬·¢ÉśŃõ»Æ·“Ó¦µÄĪļÖŹŹĒ £»Čō×ŖŅĘ1molµē×Ó£¬Éś³É±ź×¼×“æöĻĀCO2 L”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±ź³öĻĀĮŠ·“Ó¦µē×Ó×ŖŅʵķ½ĻņŗĶ×ÜŹż£ŗ
2Fe(NO3)3 + 16NaOH + 3Cl2 ”ś 2Na2FeO4 + 6NaNO3 + 6NaCl + 8H2O________________
£Ø1£©·“Ó¦ÖŠ______ŌŖĖŲ±»Ńõ»Æ, »¹Ō¼ĮŹĒ__________, »¹Ō²śĪļŹĒ_______£¬·¢Éś»¹Ō·“Ó¦µÄĪļÖŹŹĒ_________
£Ø2£©Čō·“Ó¦ÖŠ×ŖŅĘĮĖ0.2 molµē×Ó£¬ŌņĻūŗÄĮĖ_______L Cl2£Ø±ź×¼×“æö£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³ŃŠ¾æŠ”×éĄūÓĆČēĶ¼×°ÖĆĢ½¾æSO2ŗĶFe(NO3)3ČÜŅŗµÄ·“Ó¦ŌĄķ”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø £©
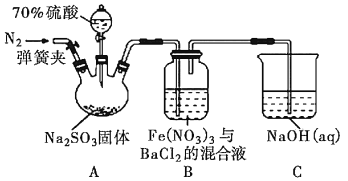
A.×°ÖĆBÖŠČō²śÉś°×É«³Įµķ£¬ĖµĆ÷Fe3+Äܽ«SO2Ńõ»Æ³ÉSO![]()
B.ŹµŃéŹŅÖŠÅäÖĘ¼Ó70%µÄĮņĖįŠčŅŖµÄ²£Į§ŅĒĘ÷ÓŠĮæĶ²”¢ÉÕ±”¢²£Į§°ō
C.Čż¾±ÉÕĘæÖŠĶØČėN2µÄ²Ł×÷Ó¦ŌŚµĪ¼ÓÅØĮņĖįÖ®Ē°£¬ÄæµÄŹĒÅž”×°ÖĆÄŚµÄæÕĘų
D.×°ÖĆCæÉÄÜ·¢Éśµ¹Īü£¬Ķ¬Ź±»¹²»ÄÜĶźČ«ĪüŹÕ·“Ó¦²śÉśµÄĪ²Ęų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫0.65gŠæ¼ÓČė50mL 1mol/L µÄĻ”ŃĪĖįÖŠ£¬¼ĘĖć£ŗ
£Ø1£©±ź×¼×“æöĻĀ£¬Éś³ÉH2µÄĢå»ż_________£»
£Ø2£©·“Ó¦ŗóČÜŅŗÖŠZn2+ŗĶH+µÄĪļÖŹµÄĮæÅØ¶Č£Ø¼ŁÉč·“Ó¦ŗó£¬ČÜŅŗĢå»żČŌĪŖ50mL£©_________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æH2ŗĶI2ŌŚŅ»¶ØĢõ¼žĻĀÄÜ·¢Éś·“Ó¦£ŗH2(g)£«I2(g)![]() 2HI(g) ¦¤H£½£akJ/mol£¬ŅŃÖŖ(a”¢b”¢c¾ł“óÓŚĮć)£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
2HI(g) ¦¤H£½£akJ/mol£¬ŅŃÖŖ(a”¢b”¢c¾ł“óÓŚĮć)£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©

A.·“Ó¦ĪļµÄ×ÜÄÜĮæµĶÓŚÉś³ÉĪļµÄ×ÜÄÜĮæ
B.¶ĻæŖ1molH”ŖH¼üŗĶ1molI”ŖI¼üĖłŠčÄÜĮæ“óÓŚ¶ĻæŖ2 molH”ŖI¼üĖłŠčÄÜĮæ
C.¶ĻæŖ2mol H”ŖI¼üĖłŠčÄÜĮæŌ¼ĪŖ(c£«b£«a)kJ
D.ĻņĆܱÕČŻĘ÷ÖŠ¼ÓČė2molH2ŗĶ2molI2£¬³ä·Ö·“Ó¦ŗó·Å³öµÄČČĮæµČÓŚ2akJ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com