
(14分)已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
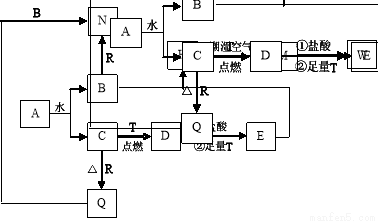
(1)写出下列物质的化学式:D:____________,R:_______________;
写出下列物质的电子式A: ;
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式:__________________;
B与R反应的化学方程式:___________________________ ;
D与盐酸反应的离子方程式:________________________。
(3)向沸水中加入W饱和溶液,可制得一种红褐色胶体,该反应的离子方程式为:_________。
(1)D:Fe3O4 R:Al A: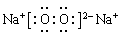 (2) 4Fe(OH)2 +O2+2H2O=4Fe(OH)3
(2) 4Fe(OH)2 +O2+2H2O=4Fe(OH)3
2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Fe3O4 + 8H+= Fe2+ + 2Fe3+ + 4H2O
(3)Fe3++3H2O Fe(OH)3 (胶体)+3H+
Fe(OH)3 (胶体)+3H+
【解析】
试题分析:A为淡黄色固体,且A能和水反应生成无色无味气体C,则A是Na2O2,则C是O2、B是NaOH;D是具有磁性的黑色晶体,则D是Fe3O4,金属T在氧气中燃烧生成四氧化三铁,则T是Fe,四氧化三铁与足量的盐酸、足量的Fe反应得到E,E与B(NaOH)反应得到白色沉淀H,则E为FeCl2,H是Fe(OH)2,H在潮湿的空气中得到M为Fe(OH)3,M与HCl反应生成W,则W是FeCl3,金属R和氧气反应生成氧化物Q,Q能和NaOH溶液反应,则R是Al、Q是Al2O3、N是NaAlO2,则
(1)通过以上分析知,D、R分别是Fe3O4、Al;A是过氧化钠,含有离子键和非极性键,电子式为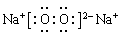 。
。
(2)H在潮湿空气中被氧化变成M的过程中的化学方程式4Fe(OH)2 +O2+2H2O=4Fe(OH)3;铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;四氧化三铁与盐酸反应生成氯化铁、氯化亚铁和水,反应的离子方程式为Fe3O4 + 8H+= Fe2+ + 2Fe3+ + 4H2O。
(3)向沸水中加入氯化铁饱和溶液,可制得一种红褐色氢氧化铁胶体,该反应的离子方程式为Fe3++3H2O Fe(OH)3 (胶体)+3H+。
Fe(OH)3 (胶体)+3H+。
考点:考查无机框图题的推断


科目:高中化学 来源:2015届四川省绵阳市高三“一诊”模拟考试理综化学试卷(解析版) 题型:填空题
(15分)某同学查阅资料设计合成抗氧化剂I和高分子化合物G路线如下:
已知:①A分子中含有3个甲基 ②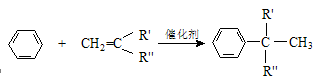
请回答下列问题:
(1)C的分子式为 , A的名称为 ,
(2)反应①的反应条件为 ,G的结构简式为
(3)写出D与新制Cu(OH)2溶液反应的化学方程式:
(4)上述反应中属于取代反应的是 (填序号)
(5)F存在多种同分异构体,写出满足下列条件的所有同分异构体
①能发生水解反应,且能使溴的四氯化碳溶液褪色 ②核磁共振氢谱显示有3种氢
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:填空题
(12 分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
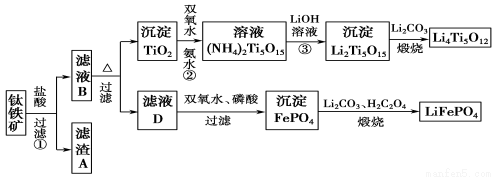
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
(1)若在实验室中煅烧固体混合物,会用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有 (填仪器名称)。流程中多次涉及沉淀,则洗涤沉淀的方法是 。
(2)生产中利用滤渣A制备半导体的反应是 。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度有关,反应温度过高时,Ti元素浸出率会下降,其原因是 。
(5)写出由滤液D生成FePO4的离子方程式 。由滤液D制备LiFePO4的过程中,所需双氧水与H2C2O4的物质的量比是 。
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数,下列叙述正确的是
A.0.1 mol丙烯酸中含有双键的数目为0.1NA
B.常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应为0.1NA
C.一定条件下定容容器中充入3molH2(g)和1 mol N2(g)发生反应:H2(g)+ N2(g) 2NH3 (g);△H= -QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25 NA
2NH3 (g);△H= -QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25 NA
D.在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
下列说法正确的是
①乙烯的结构简式:CH2CH2
②HF的电子式: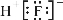
③HClO的结构式:H—O—Cl
④基态碳原子的价电子排布图: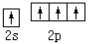
⑤基态Cr的价电子排布式:3d44s2
⑥斜长石KAlSi3O8的氧化物形式可表示为:K2O?Al2O3?6SiO2
A.①③ B.③④ C.④⑤ D.③⑥
查看答案和解析>>
科目:高中化学 来源:2015届吉林省长春外国语学校高三上学期期中理综化学试卷(解析版) 题型:选择题
对某酸性溶液(可能含有Br―,SO42—,H2SO3,NH4+)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在溶液中是否存在的是
A.Br― B.SO42— C.H2SO3 D.NH4+
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高三第三次月考化学试卷(解析版) 题型:选择题
实验室制取少量N2常利用的反应是NaNO2+NH4Cl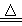 NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
A.NaNO2是还原剂
B.生成1molN2时转移的电子为6mol
C.NH4Cl中的N元素被氧化
D.N2既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高三第三次月考化学试卷(解析版) 题型:选择题
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是
①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转化技术;
④田间焚烧秸秆;⑤推广使用节能环保材料。
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2015届吉林省吉林市高三第一次摸底考试化学试卷(解析版) 题型:选择题
CO(g)+NO2(g)  CO2(g)+NO(g) △H<0,若其他条件不变,只改变下列条件,能使混合气体颜色变深的是
CO2(g)+NO(g) △H<0,若其他条件不变,只改变下列条件,能使混合气体颜色变深的是
A.降低温度 B.增大压强 C.增大CO的浓度 D.使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com