
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成分的药量 | 0.245g | 0.5g |
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
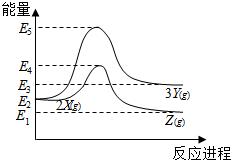
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H>0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇和溴苯 | |
| B. | 用红外光谱鉴别丙醛和1-丙醇 | |
| C. | 用溴水鉴别苯和正庚烷 | |
| D. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g重水(D2O)所含的中子数为10NA | |
| B. | 100℃时,1LpH=1的硫酸溶液中,含有0.2NA个H+ | |
| C. | 71g氯气发生氧化还原反应,一定失去2NA个电子 | |
| D. | 室温下,14gN2和CO的混合气体中含有的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol•L-1NaOH溶液500mL,根据溶液的配制情况,回答下列问题:
实验室需要0.1mol•L-1NaOH溶液500mL,根据溶液的配制情况,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子的结构示意图为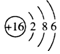 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 氢弹中用到的2H、3H互为同位素 | |
| D. | 同种元素的原子均有相同的质子数和中子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钡、四氯化碳、硫酸、碘酒都属于化合物 | |
| B. | 硝酸、纯碱、磷酸钠、二氧化碳分别属于酸、碱、盐、氧化物 | |
| C. | 溶液、浊液、胶体、空气都属于混合物 | |
| D. | CO2、SO2、P2O5、CO都属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
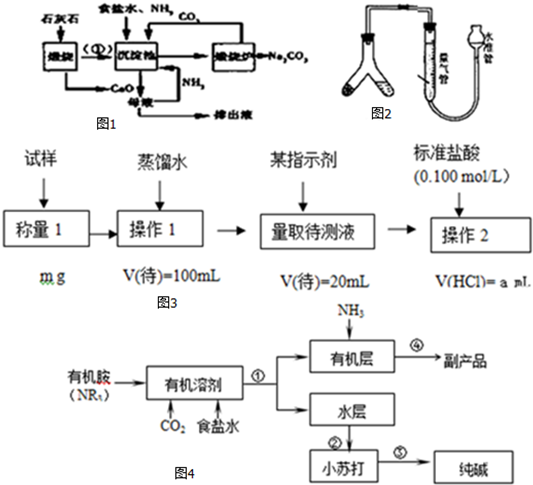
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com