
(13分)铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题。
(1)工业上可用Cu2S+O2 2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃-60℃,加入H2O2,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:________________.CuSO4 溶液中加入一定量的Na2SO3溶液和NaCI溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________。
溶液中加入一定量的Na2SO3溶液和NaCI溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________。
(3)电子工业常用30%的FeCl3溶液腐蚀附在绝缘板上的铜箔制造印刷电路板,取其腐蚀后的废液,加入一定量的铁粉后,若无固体剩余,则反应后的溶液中肯定有的离子是________________;若有红色固体,则反应后的溶液中肯定没有的离子是________,检验该离子的试剂为________。
(4)铁氰化钾 K3[Fe(CN)5]和亚铁氰化钾K4[Fe(CN)6] 的混合溶液可用于太阳能电池的电解液,该太阳能电池的工作原理示意图如图所示,其中催化剂a为________极,电极反应式为________;

(1)1.2mol;(2)Cu+2H++H2O2=Cu2++2H2O;2Cu2++SO32-+2Cl- 2CuCl↓+SO42-+2H+;
2CuCl↓+SO42-+2H+;
(3)Fe2+、Cu2+;Fe3+;KSCN溶液;(4)负;[Fe(CN)6]4- -e-=[Fe(CN)6]3-
【解析】
试题分析:(1)在Cu2S+O2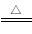 2Cu+SO2反应中,每有1mol的Cu2S发生反应,转移电子的物质的量是6mol,当消耗32 g Cu2S时,n(Cu2S)=32g÷160g/mol=0.2mol,所以转移电子的物质的量为n(e-)=0.2mol ×6 =1.2mol;(2)在酸性条件下,H2O2将Cu氧化为Cu2+,它本身被还原为H2O,发生反应的离子方程式为:Cu+2H++H2O2=Cu2++2H2O;(3)电子工业常用30%的FeCl3溶液腐蚀附在绝缘板上的铜箔制造印刷电路板,会发生反应:2FeCl3+Cu=2FeCl2+CuCl2;取其腐蚀后的废液,加入一定量的铁粉后,若无固体剩余,说明发生了反应: 2FeCl3+Fe=3FeCl2;没有发生Fe与Cu的置换反应,则反应后的溶液中肯定有的离子是Fe2+、Cu2+;若有红色固体,则该固体是Cu,由于Cu会和FeCl3发生反应:2FeCl3+Cu=2FeCl2+CuCl2;反应后得到了Cu,则溶液中肯定没有的离子是Fe3+;Fe3+与SCN-会发生显色反应,使溶液变为血红色,所以检验该离子的试剂为KSCN溶液;(4)根据图示可知催化剂a失去电子,是负极;电极反应式为[Fe(CN)6]4- -e-=[Fe(CN)6]3-。
2Cu+SO2反应中,每有1mol的Cu2S发生反应,转移电子的物质的量是6mol,当消耗32 g Cu2S时,n(Cu2S)=32g÷160g/mol=0.2mol,所以转移电子的物质的量为n(e-)=0.2mol ×6 =1.2mol;(2)在酸性条件下,H2O2将Cu氧化为Cu2+,它本身被还原为H2O,发生反应的离子方程式为:Cu+2H++H2O2=Cu2++2H2O;(3)电子工业常用30%的FeCl3溶液腐蚀附在绝缘板上的铜箔制造印刷电路板,会发生反应:2FeCl3+Cu=2FeCl2+CuCl2;取其腐蚀后的废液,加入一定量的铁粉后,若无固体剩余,说明发生了反应: 2FeCl3+Fe=3FeCl2;没有发生Fe与Cu的置换反应,则反应后的溶液中肯定有的离子是Fe2+、Cu2+;若有红色固体,则该固体是Cu,由于Cu会和FeCl3发生反应:2FeCl3+Cu=2FeCl2+CuCl2;反应后得到了Cu,则溶液中肯定没有的离子是Fe3+;Fe3+与SCN-会发生显色反应,使溶液变为血红色,所以检验该离子的试剂为KSCN溶液;(4)根据图示可知催化剂a失去电子,是负极;电极反应式为[Fe(CN)6]4- -e-=[Fe(CN)6]3-。
考点:考查氧化还原反应中物质的作用及电子转移的计算、离子的检验、存在、离子方程式的书写即原电池反应原理中电极的判断、电极反应式的书写的知识。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:2014-2015江苏省泰州市姜堰区高一上学期期末化学试卷(解析版) 题型:选择题
下列应用或解释合理的是
A.丁达尔效应是区分胶体和溶液的一种常用物理方法
B.SO2具有漂白性,可使紫色石蕊试液褪为无色
C.氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液
D.在实验室里,常用电解饱和食盐水的方法制取氯气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市四校高三3月联合考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1 mol [Cu(NH3)4]2+ 中含有σ键的数目为12NA
B.0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA
C.分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
D.用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:选择题
下列描述正确的是
A.氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同
B.滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存
C.某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42-
D.Fe(NO3)2溶液中滴加少量稀硫酸会变黄色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:选择题
下列说法正确的是
A.在加碘食盐中,碘以单质形式存在
B.纳米材料是指一种称为“纳米”的新物质制成的材料
C.光导纤维是以二氧化硅为主要原料制成的
D.绿色食品是指不含任何化学物质的食品
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.工业上电解熔融的Al2O3冶炼铝用铁做阳极
B.用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子 转移,则生成2 molNaOH
转移,则生成2 molNaOH
D.用惰性电极电解CuSO4溶液一段时间后,加入CuO固体可以使CuSO4溶液恢复原来浓度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
仅用下表提供的玻璃仪器(非玻璃仪器和药品任选),不能实现相应实验目的的是
选项 | 实验目的 | 玻璃仪器 |
A. | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管 |
B | 实验室用浓氨水和生石灰制备氨气 | 普通漏斗、烧杯、玻璃棒 |
C | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 |
D | 分离乙醇和乙酸乙酯的混合物 | 分液漏斗、烧杯 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
物质 组别 | 甲 | 乙 | 丙 |
A | FeCl2 | Cl2 | NaOH |
B | SiO2 | NaOH | HF |
C | AlCl3 | KOH | H2SO4 |
D | SO2 | NaOH | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列叙述正确的是
A.由于相对分子质量:HCl>HF,故沸点:HCl>HF
B.硅处于金属与非金属的过渡位置,硅可用作半导体材料
C.由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在
D.Cl-、S2-、Ca2+、K+半径逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com