
【题目】已知8838Sr位于IIA族,下列有关Sr的说法不正确的是 ( )
A. 原子半径:Sr > Ca B. 最高化合价为+2
C. 8838Sr的中子数为38 D. 氢氧化物为强碱
科目:高中化学 来源: 题型:
【题目】(13分)锰、铝、铁、钠的单质及其化合物在工业生产中有着广泛应用。请回答下列问题:
(1)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式来表示) 。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是 。
(2)将一定量的铁粉在氯气中燃烧后所得固体溶于水可得到溶液X。取少量X溶液两份,一份加入KSCN 溶液时,溶液显红色;另一份中加入黄色铁氰化钾 (K3[Fe(CN)6])溶液后能发生复分解反应生成蓝色沉淀。已知:K3[Fe(CN) 6]的电离方程式为K3[Fe(CN)6]= 3K++[Fe(CN) 6]3-。请分析:
①用化学方程式表示产生两种金属阳离子的原因 。
②蓝色沉淀是由铁氰化钾与低价态阳离子反应的结果,试写出该反应的离子方程式 。
(3)将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化。
请完成下列问题:
①反应过程中共得到的气体的体积为 (标准状况);
②最终是否有沉淀产生? (填“是”或“否”),若有沉淀产生,其质量为 。 (若不存在,则不必回答第(2)问)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在pH=12的NaOH溶液中,由水电离出的c(OH-)为( )
A.1.0×10-7mol/LB.1.0×10-6mol/L
C.1.0×10-3mol/LD.1.0×10-12mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸铝广泛用于化工、石油等生产上,120150℃左右分解。在0℃时,溶解度为16g,100℃时,溶解度为18.4g。
首先用废铝渣制取AI(OH)3固体,流程如下:
![]()
(1)调节pH用_________试剂为好。某同学在减压过滤时,布氏漏斗内没有得到产品,可能原因是______________________。
然后将氢氧化铝和甲醛依次加入到质量分数为50%的过氧化氢溶液中(投料物质的量之比依次为1∶3∶2),装置如图1.最终可得到含甲酸铝90%以上的优质产品。反应式为:2Al(OH)3+6HCHO+3H2O2=2Al(HCOO)3+6H2O+3H2↑。
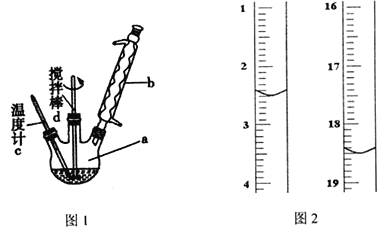
(2)反应过程可看作两步进行,第一步______________(写出化学方程式),第二步为甲酸与Al(OH)3 反应生成甲酸铝。
(3)反应温度最好控制在30—70℃之间,温度不宜过高,主要原因是_________________。
(4)实验时需强力搅拌45 min,最后将溶液____________,抽滤,洗涤,干燥得产品。可用酸性KmnO4标准溶液滴定法来测定产品纯度,滴定起始和终点的滴定管液面位置见上图2, 则消耗的酸性KmnO4标准溶液体积为__________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
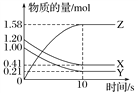
(1)从反应开始到10 s时,用Z表示的反应速率为________________________,X的物质的量浓度减少了_________________,Y的转化率为__________。
(2)该反应的化学方程式为________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com