
电解84.75 mL 16%的NaOH溶液(ρ=1.18 g·cm-3),用石墨作电极经过一段时间后溶液浓度为19.5%,这是因为( )
A.溶质增加了3.5 g
B.放出了22.4 L H2和11.2 L O2
C.NaOH比水消耗少
D.消耗18 g水
科目:高中化学 来源: 题型:
在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH=-Q kJ·mol-1在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成1 mol SO3固体放热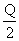 kJ
kJ
B.2Q3<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列反应的热化学方程式:
(1)N2(g)与H2(g)反应生成1 mol NH3(g),放出46.1 kJ热量________。
(2)1 mol C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量________。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)===CO2(g) ΔH=E1①
b.C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2②
H2(g)+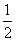 O2(g)===H2O(g) ΔH=E3③
O2(g)===H2O(g) ΔH=E3③
CO(g)+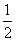 O2(g)===CO2(g) ΔH=E4④
O2(g)===CO2(g) ΔH=E4④
回答:
(1)上述四个热化学方程式中的哪些反应ΔH<0?
________________________________________________________________________。
(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是( )
A.a比b多 B.a比b少 C.a与b在理论上相同
(3)根据能量守恒定律,E1、E2、E3、E4之间的关系为________________________
________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子的物质的量为
( )
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是( )
A.“四中子”不显电性
B.“四中子”的质量数为4,其质量比氢原子大
C.“零号元素”在元素周期表中与氢元素占同一位置
D.第二种粒子的化学式为O4,与O2互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是( )
A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子的半径越小,还原性越强
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质及其用途不正确的是( )
A.锂电池是新一代可充电的绿色电池,成为笔记本电脑、移动电话等低功耗电器的主流电池
B.铜盐溶液都有毒,但硫酸铜常用来配制电解液和农药;而且在生命体中,铜也是一种不可缺少的微量元素
C.玻璃、水泥、陶瓷和黏土都是硅酸盐产品,应用于生产、生活的各个领域
D.氨是一种重要的化工产品,是氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2(g)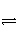
 N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
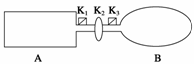
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若通人等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深。
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com