
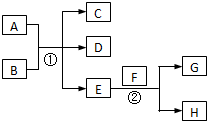
 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题: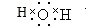 .
.分析 根据E为无色无味的液体,F为淡黄色粉末,则F为过氧化钠,E为水,G为氧气,H为氢氧化钠,
(1)E为水,水分子中有两对氢氧共用电子对,据此书写电子式;
(2)若A与B均为固体化合物,D是一种能使湿润的红色石蕊试纸变蓝的气体,即D为氨气,反应①是实验室制备氨气的反应,则A、B应为氯化铵和氢氧化钙;
(3)若A为红色固体,D一种是能可使品红溶液褪色的气体,即D为二氧化硫,则A为铜,B为浓硫酸,据此书写反应①的化学方程式;
(4)若A、C、D均含有氯元素,且A中的化合价介于C与D之间,则反应①应为氯气与碱的反应,氯气发生自身氧化还原,据此书写离子方程式.
解答 解:根据E为无色无味的液体,F为淡黄色粉末,则F为过氧化钠,E为水,G为氧气,H为氢氧化钠,
(1)E为水,水分子中有两对氢氧共用电子对,其电子式为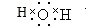 ,
,
故答案为: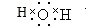 ;
;
(2)若A与B均为固体化合物,D是一种能使湿润的红色石蕊试纸变蓝的气体,即D为氨气,反应①是实验室制备氨气的反应,则A、B应为氯化铵和氢氧化钙,其化学式为NH4Cl、Ca(OH)2,
故答案为:NH4Cl、Ca(OH)2;
(3)若A为红色固体,D一种是能可使品红溶液褪色的气体,即D为二氧化硫,则A为铜,B为浓硫酸,铜 与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)若A、C、D均含有氯元素,且A中的化合价介于C与D之间,则反应①应为氯气与碱的反应,氯气发生自身氧化还原,反应的离子方程式为 Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查的是物质或离子的推断、离子方程式的书写、物质的量的有关计算,属于综合知识的考查,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与CO2反应 | B. | 铝片与稀H2SO4反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 甲烷在O2中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在SiO2晶体中,1个Si原子和2个O原子形成两条共价键 | |
| B. | 由多种非金属元素组成的化合物一定是共价化合物 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 晶体熔化时化学键不一定发生断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com