
分析 (1)导电的物质是含自由电子的金属、电解质溶液或熔融状态的电解质;
(2)水溶液中或熔融状态下导电的化合物为电解质;
(3)导电的物质是含自由电子的金属、电解质溶液或熔融状态的电解质;
(4)水溶液中完全电离的电解质为强电解质;
(5)水溶液中部分电离的电解质为弱电解质.
解答 解:(1)导电的物质是含自由电子的金属、电解质溶液或熔融状态的电解质,A.NaOH溶液,B.Cu,G.氨水,I.石墨都可以导电,故答案为:ABGI;
(2)水溶液中或熔融状态下导电的化合物为电解质,C.液态 HCl,D.液态 CH3COOH,H. 无水胆矾,属于电解质,故答案为:CDH;
(3)导电的物质是含自由电子的金属、电解质溶液或熔融状态的电解质,A.NaOH溶液,B.Cu,G.氨水,I.石墨都可以导电,故答案为:ABGI;
(4)水溶液中完全电离的电解质为强电解质,C.液态 HCl,H. 无水胆矾水溶液中全部电离属于强电解质,故答案为:CH;
(5)水溶液中部分电离的电解质为弱电解质 D.液态 CH3COOH水溶液中部分电离属于弱电解质,故答案为:D.
点评 本题考查了化合物分类、电解质中的强电解质和弱电解质、非电解质概念实质的理解应用,掌握基础是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
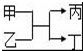 若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )| A. | 钠和氢气 | B. | 硫和氧 | C. | 碳和硅 | D. | 氯气和溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯与环丁烷互为同系物 | |
| B. | 碳氢化合物中的化学键都是极性键 | |
| C. | 乙醇与金属钠反应时,乙醇分子中的C-H键断裂 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
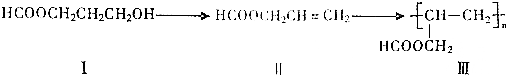
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| B. | 2HCO3-+2AlO2-+H2O=2CO2↑+2Al(OH)3↓ | |
| C. | NH4++AlO2-+2H2O=NH3•H2O+Al(OH)3↓ | |
| D. | 3H++Al(OH)3=Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com