
分析 (1)已知①TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1;
②2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1,
TiO2和焦炭、氯气反应生成TiCl4和CO气体的化学方程式为:2C+TiO2+2Cl2═TiCl4+2CO,可以根据①+②计算得到;
(2)已知::①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414kJ•mol-1
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ•mol-1
Na2O2和Na生成Na2O的化学方程式为:2Na+Na2O2=2Na2O,可以根据①×2-②得到;
(3)已知:①C (s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ•mol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=-2599kJ•mol-1;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$得到.
解答 解:(1)已知①TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1;
②2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1,
TiO2和焦炭、氯气反应生成TiCl4和CO气体的化学方程式为:2C+TiO2+2Cl2═TiCl4+2CO,可以根据①+②得到,所以反应的焓变═+140kJ•mol-1+(=-221kJ•mol-1)=-81kJ•mol-1,
故答案为:2C(s)+TiO2(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ•mol-1;
(2)已知::①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414kJ•mol-1
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ•mol-1
Na2O2和Na生成Na2O的化学方程式为:2Na+Na2O2=2Na2O,可以根据①×2-②得到,所以反应的焓变=(-414kJ•mol-1)×2-(-511kJ•mol-1)=-317kJ•mol-1,
故答案为:2Na(s)+Na2O2(s)=2Na2O(s)△H1=-317kJ•mol-1;
(3)已知:①C (s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ•mol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=-2599kJ•mol-1;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$得到,
所以反应焓变△H=2×(-393.5kJ•mol-1)+(-571.6kJ•mol-1)×$\frac{1}{2}$-(-2599kJ•mol-1)×$\frac{1}{2}$=226.7kJ•mol-1,
故答案为:2C (s,石墨)+H2(g)=C2H2(g),△H1=226.7kJ•mol-1
点评 本题考查学生盖斯定律的应用和热化学方程式的书写方面的知识,注意教材知识的灵活应用是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )
固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )| A. | 该电池的反应方程式为I2+2Ag═2AgI | |
| B. | 石墨电极为正极,银电极为负极 | |
| C. | 正极的电极反应是:Ag-e-═Ag+ | |
| D. | 装置中电子移动的途径是:银电极→导线→石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.4g白磷晶体中含有的P-P键数是0.4NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 2 mol SO2和1 molO2在一定条件下的密闭容器中反应,反应后分子总数大于2 NA | |
| D. | 1mol甲醇中含有C-H键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
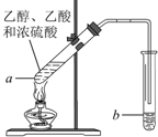 实验室制乙酸乙酯的主要装置如图所示,主要步骤为:
实验室制乙酸乙酯的主要装置如图所示,主要步骤为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焦炭还原法 | B. | 湿法炼铜 | C. | 铝热还原法 | D. | 电解冶炼法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| B. | 煤经过气化、液化等物理变化可得到清洁燃料 | |
| C. | 煤的干馏、石油裂化、石油裂解都是化学变化 | |
| D. | 棉花、羊毛、蚕丝、麻都由C、H、O元素构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH $\stackrel{加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O.
(1)写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH $\stackrel{加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com