
 ;
;分析 (1)乙酸和乙醇可以发生酯化反应;
(2)苯易发生取代反应,与浓硝酸、浓硫酸的混合酸共热时发生硝化反应生成硝基苯;
(3)乙醇在铜做催化剂条件下发生反应生成乙醛和水;
(4)金属铝与四氧化三铁在高温下反应生成氧化铝和金属铁.
解答 解:(1)乙酸和乙醇可以发生酯化反应,实质是:酸掉羟基醇掉氢,即CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)苯易发生取代反应,与浓硝酸、浓硫酸的混合酸共热时发生硝化反应,即
故答案为:
(3)乙醇催化氧化生成乙醛和水,方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)金属铝与四氧化三铁反应生成金属铁和氧化铝,反应的化学方程式为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,
故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe.
点评 本题考查了化学方程式的书写,侧重考查有机反应的化学方程式书写,明确有机物结构特点及性质是解题关键,注意酯化反应为可逆反应,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 |
| n(HI) | 1 | 0.91 | n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
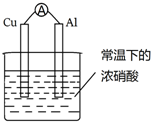
| A. | Cu是原电池的负极 | |
| B. | 电流由Cu电极流出 | |
| C. | 电子由Al沿导线流向Cu | |
| D. | 铝片上的电极反应式为:Al-3e-═Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅是良好的半导体材料 | B. | 硅常温时可以和强碱反应 | ||
| C. | 二氧化硅广泛存在于自然界 | D. | 硅酸是挥发性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 离子半径:X+>Z- | C. | 稳定性:H2Y>HZ | D. | 碱性:XOH>W(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑦ | B. | ②④⑥⑧ | C. | ③⑤⑦⑧ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | YX2和WX3均属于离子化合物 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2Y3具有氧化性和还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com