

| A. | 青蒿素的分子式是C15H22O5,属于烃的衍生物 | |
| B. | 双氢青蒿素中含有过氧键,遇湿润的淀粉碘化钾试纸立刻显蓝色 | |
| C. | 蒿甲醚可以发生水解反应 | |
| D. | 反应②为取代反应,有H2O生成 |
科目:高中化学 来源: 题型:填空题
 25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图 (忽略溶液体积的变化、H2S的挥发).
25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图 (忽略溶液体积的变化、H2S的挥发).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径A>B>D>C | B. | 原子序数d>c>b>a | ||
| C. | 离子半径C3->D->B+>A2+ | D. | 还原性D->C3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | 乙醇的结构简式:C2H6O | |
| C. | S2-的结构示意图: | |
| D. | 甲烷分子的比例模型是 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 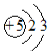 可以表示10B的原子结构,但不能表示11B的原子结构 可以表示10B的原子结构,但不能表示11B的原子结构 | |
| B. | 聚乙烯的结构简式:-[CH2-CH2]- | |
| C. | CH4的球棍模型: | |
| D. | 次氯酸分子的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,一定有CO32- | |
| B. | 加入盐酸酸化的氯化钡,溶液中有白色沉淀产生,溶液中不一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com