
【题目】制备钙掺杂纳米Fe3O4,并模拟吸附废水中磷元素的主要实验流程如下:

已知:①CaO2能氧化溶液中的FeCl2,反应生成Fe(OH)3和Fe3+。
②掺杂的Ca2+嵌入Fe3O4中,洗涤时不损失,吸附时不形成Ca3(PO4)2等沉淀。
③溶液的pH对吸附剂表面所带电荷有影响。pH越高,表面所带负电荷越多; pH越低,表面所带正电荷越多。
(1)向FeCl2、FeCl3混合溶液中滴加NaOH溶液,一定条件下反应生成Fe3O4,其离子方程式为___________。
(2)步骤Ⅱ调节pH至11,共沉淀需在70℃条件下进行,适宜的加热方式为________。为提高共沉淀效果,还可采取的措施为_______________。
(3)磷元素的吸附效果、H3PO4水溶液中含磷物种分布分数与pH的关系分别如图1和图2所示。
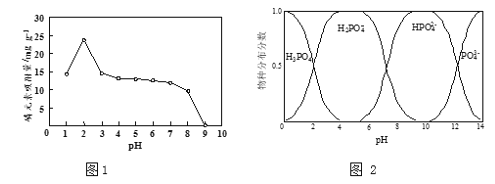
①步骤Ⅳ用KH2PO4溶液模拟废水,测得酸性条件下(pH > 2)对磷元素吸附量较大,原因是:pH越低,吸附剂表面所带正电荷越多,有利于吸附阴离子;___________________
②步骤Ⅴ将吸附剂取出,用碱液解吸回收磷。结合表中数据,分析钙掺杂纳米Fe3O4吸附剂与其他类型吸附剂相比的优势有:________。
不同类型吸附剂对磷酸盐吸附能力比较
吸附剂 | 本产品 | 纯Fe3O4 | 陶瓷材质 |
吸附量/mg·g-1 | 24.1 | 5.0 | 12.5 |
(4)请设计从步骤Ⅱ反应结束后的烧瓶中获取钙掺杂纳米Fe3O4产品的实验方案:用磁铁将沉淀物和溶液分离,______________,用筛网筛分得到产品 (实验中须使用的试剂和仪器有:蒸馏水、无水乙醇、pH计、研钵、烘箱)。
【答案】Fe2++2Fe3++8OH-= Fe3O4 ↓+ 4H2O 水浴加热 搅拌 磷元素酸性条件下主要以H2PO4-形态存在,比HPO42-所带负电荷少,有利于被吸附 吸附量大(或解吸后可以循环利用) 用蒸馏水洗涤沉淀物至洗出液用pH计检测接近中性,再用无水乙醇洗涤,将所得固体置于烘箱中烘干后,在研钵中研磨
【解析】
根据流程:FeCl24H2O用CaO2氧化,部分被氧化为Fe(OH)3和Fe3+,加入水得到FeCl2、FeCl3混合溶液,加入NaOH溶液制得钙掺杂纳米Fe3O4,钙掺杂纳米Fe3O4吸附KH2PO4溶液,加入NaOH溶液解吸回收磷,
(1)根据电荷守恒、质量守恒书写可得;
(2)100℃以下与水浴加热;搅拌可以促进混合;
(3)①根据图,磷元素酸性条件下主要以H2PO4-形态存在,结合已知③分析;
②由表可知,钙掺杂纳米Fe3O4吸附剂吸附能力强;
(4)从步骤Ⅱ反应结束后的烧瓶中获取钙掺杂纳米Fe3O4产品,用磁铁将沉淀物和溶液分离,用蒸馏水洗涤至洗涤液显中性,再用无水乙醇洗涤,最后烘干研磨。
(1)FeCl2、FeCl3混合溶液中滴加NaOH溶液,一定条件下反应生成Fe3O4,离子反应为:Fe2++2Fe3++8OH=Fe3O4↓+4H2O;
故答案为:Fe2++2Fe3++8OH=Fe3O4↓+4H2O;
(2)共沉淀需在70℃条件下进行,选用水浴加热;搅拌可以促进反应物混合,提高共沉淀效果;
故答案为:水浴加热;搅拌;
(3)①已知:pH越低,吸附剂表面所带正电荷越多,有利于吸附阴离子,由图可知,磷元素酸性条件下主要以H2PO4形态存在,比HPO42所带负电荷少,有利于被吸附;
故答案为:磷元素酸性条件下主要以H2PO4形态存在,比HPO42所带负电荷少,有利于被吸附;
②由表可知,钙掺杂纳米Fe3O4吸附剂吸附能力强,故其吸附量大,同时解吸后可以循环利用;
故答案为:吸附量大(或解吸后可以循环利用);
(4)从步骤Ⅱ反应结束后的烧瓶中获取钙掺杂纳米Fe3O4产品:用磁铁将沉淀物和溶液分离,用蒸馏水洗涤沉淀物至洗出液用pH计检测接近中性,再用无水乙醇洗涤,将所得固体置于烘箱中烘干后,在研钵中研磨,用筛网筛分得到产品;
故答案为:用蒸馏水洗涤沉淀物至洗出液用pH计检测接近中性,再用无水乙醇洗涤,将所得固体置于烘箱中烘干后,在研钵中研磨。


科目:高中化学 来源: 题型:
【题目】某实验过程如图所示:则图③的试管中的现象是
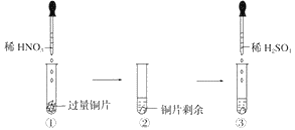
A. 无明显现象,因稀硫酸不与铜反应
B. 铜片溶解,产生无色气体,该气体遇到空气不变色
C. 铜片溶解,放出红棕色有刺激性气味的气体
D. 铜片溶解,产生无色气体,该气体在试管口变为红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在人类的生产和生活中有着广泛的应用,某化学兴趣小组利用图一装置探究氨气的有关性质。
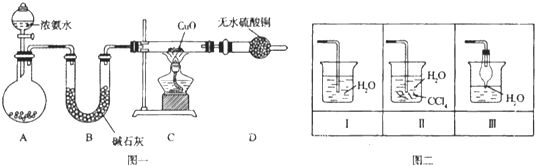
(1)装置A中烧瓶内试剂可选用 (填序号)。B的作用是
a.碱石灰 b.浓硫酸 c.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 ,.该反应证明氨气具有 性.
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号).
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,所得溶液的物质的量浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种抗血栓药物,其合成路线流程图如下:

(1)B中的含氧官能团名称为_________________(写两种)。
(2)C + G → H 的反应类型为________________。
(3)环状分子E 的分子式为C5H8O2 ,写出E的结构简式:______________________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式____________________。
①含有苯环和一种含氧官能团,能与FeCl3溶液发生显色反应;
②分子中有叁键,有一个手性碳原子,有5种不同化学环境的氢。
(5)已知: ![]() ;
;![]() 。
。
写出以![]() 和
和![]() 为原料制备
为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向![]() 盐酸中滴加
盐酸中滴加![]() 溶液,溶液的pH随
溶液,溶液的pH随![]() 溶液体积的变化如图。已知
溶液体积的变化如图。已知![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
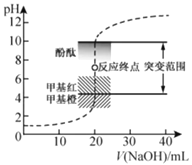
A.![]() 与盐酸恰好完全反应时,
与盐酸恰好完全反应时,![]()
B.选择变色范围在pH突变范围内的指示剂,可减小实验误差
C.选择甲基红指示反应终点,误差比甲基橙的大
D.![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是合成碳酸二苯酯的一种有效的氧化还原催化助剂,可由EDTA与Fe3+反应得到。
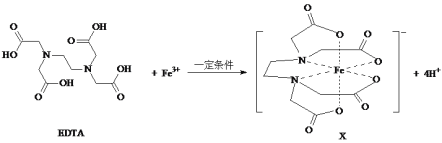
(1)EDTA中碳原子杂化轨道类型为_________________;EDTA中四种元素的电负性由小到大的顺序为__________________。
(2)Fe3+基态核外电子排布式为_________________。
(3)EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点(540.6 ℃)比正二十一烷的沸点(100 ℃)高的原因是_________。
(4)1 mol EDTA中含有σ键的数目为______________。
(5)X中的配位原子是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大________min(填“0~1”,“1~2”,“2~3”,“3~4”或“4~5”),原因是_____。
②求3~4 min时间段以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KCl溶液
C. KNO3溶液D.Na2SO4溶液
(3)某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
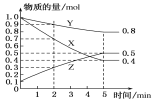
①该反应的化学方程式是_________。
②该反应达到平衡状态的标志是____(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1 mol Y的同时消耗2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物具有广泛的应用。回答下列问题:
(1)CuSO4中阳离子的基态核外电子排布式为________。
(2)S、O、N三种元素的第一电离能由小到大的顺序为_________(填元素符号)。
(3)Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2,其中NH3的空间构型为____。
(4)[Cu(NH3)4](NO3)2属于_____晶体。
(5)CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1 mol CN-中含有的π键数目为____。
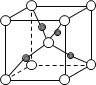
(6)已知Cu2O晶胞结构如图所示,该晶胞原子坐标参数A为(0,0,0),B为(1,0,0),C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数代表_____原子(填元素符号)。
)。则D原子的坐标参数代表_____原子(填元素符号)。

(7)金属铜的晶体晶胞中Cu原子的空间利用率是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛能够发生下列反应:
Cu2O+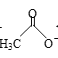
![]()
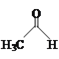
![]()

![]()

(1)Mn2+的基态电子排布式为____。
(2)氯化亚砜(SOCl2)是有机合成中重要的氯化剂,与SOCl2互为等电子体的阴离子的化学式为___。
(3)CH3CHO分子中氧原子的轨道杂化类型是____。
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是____。
(5)不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为____。
(6)如图表示Cu2O的晶胞,Cu+的配位数是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com