
分析 Ⅰ、(1)已知K2S在反应中失去电子硫元素化合价升高,则该反应的氧化剂为浓硫酸,硫元素化合价降低;
(2)已知0.5molK2S在反应中失去1mol电子生成X,浓硫酸被还原为二氧化硫,结合电子守恒计算分析硫元素化合价;
(3)计算得到K2S被氧化为S,浓硫酸被还原为SO2,电子转移依据元素化合价变化计算得到2e-;
(4)若反应中浓H2SO4过量产物中无S生成,说明硫化钾被氧化为二氧化硫;
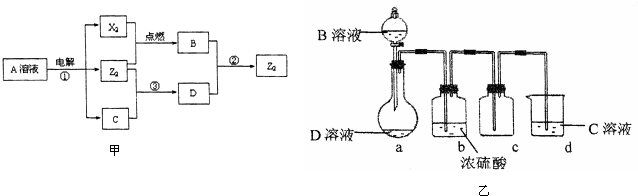
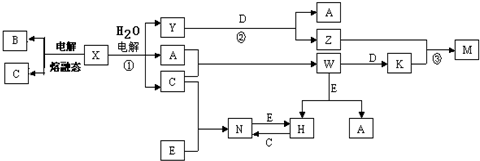
Ⅱ、短周期元素X、Y、Z的原子序数依次增大,Y与Z能形成离子个数比为1:1的离子化合物A,电解A溶液可得X2、Z2单质及C,有三种物质生成,其中两种单质,为双原子分子,应为电解水与电解质型的电解,则A为盐溶液,该盐溶液盐的阳离子不能放电,酸根离子放电,则A可能为NaCl,则Y为钠元素,Z为氯元素;X和Y同主族,且X的原子序数较小,X与Z能形成原子个数比为1:1的共价化合物,则X为氢元素.
若A为NaCl,电解NaCl溶液可得H2、Cl2单质及NaOH,H2与Cl2反应生成HCl,即B为HCl,氯气能与氢氧化钠反应生成次氯酸钠,则X2 为H2,Z2为Cl2,次氯酸钠能与HCl反应生成氯气,故符合题意.
所以X为氢元素,Y为钠元素,Z为氯元素;X2 为H2,Z2为Cl2,B为HCl,C为NaOH,D为NaClO;
(1)Y为Na元素,在第三周期,第IA族;Z2为Cl2,各原子为8电子结构,原子间含有一个共用电子对;
(2)电解氯化钠溶液生成H2、Cl2及NaOH;
(3)D溶液呈碱性的原因是次氯酸根离子水解生成次氯酸和氢氧根离子,溶液显碱性;
(4)反应②是盐酸与次氯酸钠反应;
(5)没有除去氯气中的氯化氢;
解答 解:Ⅰ、(1)反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X,已知K2S在反应中失去电子硫元素化合价升高,则该反应的氧化剂为浓硫酸,硫元素化合价降低,
故答案为:浓硫酸;
(2)已知0.5molK2S在反应中失去1mol电子生成X硫元素化合价为x,浓硫酸被还原为二氧化硫,结合电子守恒计算分析硫元素化合价,[x-(-2)]×0.5mol=1,x=0,则生成的X为S,
故答案为:S;
(3)计算得到K2S被氧化为S,浓硫酸被还原为SO2,电子转移依据元素化合价变化和电子守恒计算得到2e-,则氧化剂为浓硫酸和还原剂为K2S,配平后系数填入空格中,标出电子转移的方向和数目为: ,
,
故答案为: ;
;
(4)若反应中浓H2SO4过量产物中无S生成,同种元素不同价态间发生氧化还原反应最大程度发生归中反应,说明硫化钾被氧化为二氧化硫,反应的化学方程式为:4H2SO4(浓)+K2S=K2SO4+4SO2↑+4H2O,
故答案为:4H2SO4(浓)+K2S=K2SO4+4SO2↑+4H2O;
Ⅱ、短周期元素X、Y、Z的原子序数依次增大,Y与Z能形成离子个数比为1:1的离子化合物A,电解A溶液可得X2、Z2单质及C,有三种物质生成,其中两种单质,为双原子分子,应为电解水与电解质型的电解,则A为盐溶液,该盐溶液盐的阳离子不能放电,酸根离子放电,则A可能为NaCl,则Y为钠元素,Z为氯元素;X和Y同主族,且X的原子序数较小,X与Z能形成原子个数比为1:1的共价化合物,则X为氢元素.
若A为NaCl,电解NaCl溶液可得H2、Cl2单质及NaOH,H2与Cl2反应生成HCl,即B为HCl,氯气能与氢氧化钠反应生成次氯酸钠,则X2 为H2,Z2为Cl2,次氯酸钠能与HCl反应生成氯气.故符合题意.
所以X为氢元素,Y为钠元素,Z为氯元素;X2 为H2,Z2为Cl2,B为HCl,C为NaOH,D为NaClO.
(1)Y为Na元素,原子核外有3个电子层,最外层有1个电子,处于周期表第三周期第IA族,
故答案为:第三周期第IA族;
(2)反应①为电解氯化钠溶液,生成氢气、氯气与氢氧化钠,反应的化学方程式是2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
(3)D溶液呈碱性的原因是次氯酸根离子水解生成次氯酸和氢氧根离子,溶液显碱性,反应的离子方程式为:ClO-+H2O?HClO+OH-;
故答案为:ClO-+H2O?HClO+OH-;
(4)反应②是盐酸与次氯酸钠反应,生成氯化钠、氯气与水,反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
(5)由于盐酸具有挥发性,上述实验装置制取的氯气中含有氯化氢,应在a、b装置之间加一盛有饱和食盐水的洗气瓶,除去HCl,
故答案为:在a、b装置之间加一盛有饱和食盐水(或水)的洗气瓶,除去HCl;
点评 本题考查了物质性质的分析,氧化还原反应电子转移、产物分析判断,离子方程式书写方法,实验基本操作,掌握基础是关键,题目难度中等.


 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
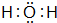 ,B的化学式NH3,C的离子符号NH4+
,B的化学式NH3,C的离子符号NH4+查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物只能由金属元素和非金属元素组成 | |
| B. | 离子化合物只能存在离子键 | |
| C. | HCl能电离出氢离子和氯离子,所以HCl存在离子键 | |
| D. | 共价化合物中不可能存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量时,应将NaOH固体放在小烧杯或玻璃器皿中 | |
| B. | 将烧杯中未冷却的NaOH溶液直接注入未经干燥的容量瓶中 | |
| C. | 定容时视线应平视凹液面(或平视刻度线),直到凹液面的最低点与刻度线相切 | |
| D. | 将称好的NaOH固体放入烧杯中,加入适量水溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阿司匹林(又称乙酰水杨酸,
阿司匹林(又称乙酰水杨酸, 是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实驻室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实驻室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为: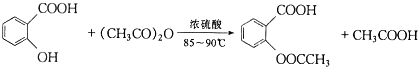
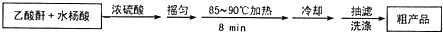

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
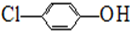 ),其原理如图1所示.
),其原理如图1所示.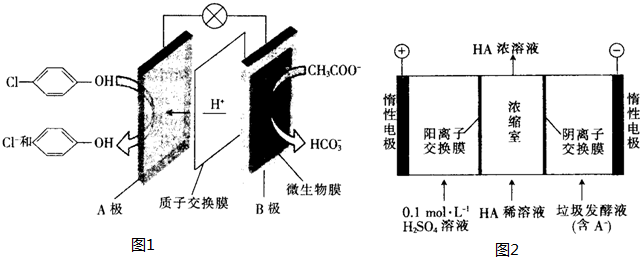
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com