
����Ŀ��һ������CO2��������̼������ɱ�ĺ�ѹ�ܱ������з�Ӧ��C��s��+CO2��g��2CO��g����ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ����֪�����ѹ��P����=������ѹ��P�������������������˵����ȷ���ǣ� �� 
A.550��ʱ��������������壬v�� �� v������С��ƽ�ⲻ�ƶ�
B.650��ʱ����Ӧ��ƽ���CO2��ת����Ϊ25.0%
C.T��ʱ��������������CO2��CO��ƽ�����淴Ӧ�����ƶ�
D.925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp=24.0P��
���𰸡�B
���������⣺A���ɱ�ĺ�ѹ�ܱ������з�Ӧ��550��ʱ������������壬�൱�ڼ�Сѹǿ����v�� �� v������С���ָ÷�Ӧ�������������ķ�Ӧ����ƽ�������ƶ�����A���� B����ͼ��֪��650��ʱ����Ӧ��ƽ���CO���������Ϊ40%���迪ʼ����Ķ�����̼Ϊ1mol��ת����xmol������
C��s��+ | CO2��g�� | 2CO��g�� | |
��ʼ | 1 | 0 | |
ƽ�� | X | 2x | |
ת�� | 1-x | 2x |
���� ![]() ��100%=40%�����x=0.25mol����CO2��ת����Ϊ
��100%=40%�����x=0.25mol����CO2��ת����Ϊ ![]() ��100%=25%����B��ȷ��
��100%=25%����B��ȷ��
C����ͼ��֪��T��ʱ����Ӧ��ƽ���CO��CO2�����������Ϊ50%��Ϊƽ��״̬������ƽ�ⲻ�ƶ�����C����
D��925��ʱ��CO���������Ϊ96%����CO2�����������Ϊ4%��������ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp= ![]() =
= ![]() =23.0P����D����
=23.0P����D����
��ѡ��B��
A���ɱ�ĺ�ѹ�ܱ������з�Ӧ��550��ʱ������������壬�൱�ڼ�Сѹǿ����v�� �� v������С���ָ÷�Ӧ�������������ķ�Ӧ����ƽ�������ƶ���
B����ͼ��֪��650��ʱ����Ӧ��ƽ���CO���������Ϊ40%���迪ʼ����Ķ�����̼Ϊ1mol����������ʽ���м��㣻
C����ͼ��֪��T��ʱ����Ӧ��ƽ���CO��CO2�����������Ϊ50%��Ϊƽ��״̬��
D��925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp= ![]() ���ݴ˼��㣻
���ݴ˼��㣻


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾���þƬ����Ƭ���缫������ͬѧ���缫����6molL��1��H2SO4��Һ�У���ͬѧ���缫����6molL��1��NaOH��Һ�У���ͼ��ʾ��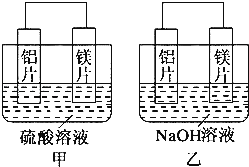
��1������SO42�������������Ƭ����þƬ������д�����������ĵ缫��Ӧʽ ��
��2�����и���Ϊ �� �ܷ�Ӧ�����ӷ���ʽ�� �� �˷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ ��
��3������ʵ��Ҳ������֤���ˡ�ֱ�����ý������˳����ж�ԭ����е���������������������ɿ������ɿ��������粻�ɿ������������һ���ж�ԭ����������Ŀ�����ʵ�鷽������ɿ����˿տɲ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaCl��Һ�л���Na2SO4��CaCl2��Һ�͵��۽��壬ѡ���ʵ����Լ��ͷ��������ᴿ��NaCl���壮��Ӧ��ʵ�������ͼ��
��1��д��ʵ������������Լ���д��ѧʽ����
�Լ������Լ��� ��
��2���ж��Լ����ѹ����ķ����ǣ� ��
��3�������ӷ���ʽ��ʾ�����Լ��ڵ����ã�
��4�������������ð�Ĥ���з����ᴿ��
�����ٵ�ʵ��������������ܡ����ܡ�������Ĥ��SO42������ܡ����ܡ�������Ĥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������գ�
��1���ڼ��ȵ������£���MnO2��100mL���ʵ���Ũ��Ϊ12mol/L��Ũ���ᷴӦ���Ƶ�����2.24L����״������Ӧ����ʽΪMnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O������˫���ŷ�����÷�Ӧ�ĵ���ת�Ƶķ������Ŀ ��
MnCl2+Cl2��+2H2O������˫���ŷ�����÷�Ӧ�ĵ���ת�Ƶķ������Ŀ ��
��2��������Ӧ�Ļ�ԭ����������ԭ��Ԫ���� ��
��3����Ҫ����MnO2���ٿˣ�����Ӧ����Һ��������䣬��Ӧ����Һ��Cl�����ʵ���Ũ���Ƕ��٣������ڴ����д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������ʵ��װ�ã���Һ�������Ϊ200mL����ʼʱ�������Һ��Ũ�Ⱦ�Ϊ0.1mol/L������һ��ʱ���õ����о�ͨ��0.02mol���ӣ����������ε�ˮ�����Һ������仯��������������ȷ���ǣ�������

A.���������������٣���
B.��Һ��pH�仯���ټ�С��������
C.�缫���������ʵ���������=��
D.�缫��Ӧʽ����������2Cl����2e���TCl2�������и���2H++2e���TH2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����绷�����˽���ȫ���ֹʹ��������������ˮ����������������ø�Ч����ɫ���������������ȣ�����������һ�ּ��ױ�ը��ǿ���������壬������ˮ�����ȶ����ʻ���ɫ����������ʹ��ʱ���뾡����ϡ���������ϡ�ͣ�ͬʱ��Ҫ������ա�����ȣ�ʵ�����Ե�ⷨ�Ʊ�ClO2���������£� 
��֪����NCl3�ǻ�ɫ��״Һ���б���ξ��壬���ױ�ը�������������Ĵ̼�����ζ����ȼ��ը��Ϊ95�棬����ˮ���ֽ⣬�ڿ������ӷ������ȶ���������B��ʹʪ��ĺ�ɫʯ����ֽ������
�ش��������⣺
��1�����ʱ��������Ӧ�Ļ�ѧ����ʽΪ �� ʵ�����Ʊ�����B�Ļ�ѧ����ʽΪ �� Ϊ��֤ʵ��İ�ȫ���ڵ��ʱ��ע��������ǣ��ٿ��ƺ�����NCl3��Ũ�ȣ��� ��
��2��NCl3��NaClO2���������ƣ������ʵ���֮��Ϊ1��6��ϣ�����Һ��ǡ�÷�Ӧ����ClO2 �� �÷�Ӧ�����ӷ���ʽΪ ��
��3��ClO2�ܲ��ȶ������������ƣ�������ˮ���յõ�ClO2��Һ��Ϊ�ⶨ������Һ��ClO2�ĺ���������������ʵ�飺 ����1��ȷ��ȡClO2��Һ10mL��ϡ�ͳ�100mL������
����2����ȡV1 mL�������뵽��ƿ�У�����������pH��2.0������������KI���壬ҡ�ȣ��ڰ�������30min
����3���Ե�����Һ��ָʾ������c mol/L Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��ҺV2 mL������֪I2+2S2O32��=2I��+S4O62����
����������3�еζ��յ����������
�ڸ�����������ɼ����ԭClO2��Һ��Ũ��Ϊg/L���ú���ĸ�Ĵ���ʽ��ʾ����
��4����һ���¶��£������ܽ������ֻ������ܵ��ܼ��е�Ũ��֮����һ������K����c��A����c��B����gL ![]() ���ֱ��ʾ������A��B�����ܼ��е�Ũ�ȣ�����
���ֱ��ʾ������A��B�����ܼ��е�Ũ�ȣ����� ![]() =K�����ڶ��ԣ�
=K�����ڶ��ԣ� ![]() =85������2.0L��ˮ�����к�I20.020g������CCl4��ȡ�������ַ�����ȡ����һ�ַ�����50mLCCl4��ȡһ�Σ��ڶ��ַ����Ƿ�������ȡ��ÿ����25mLCCl4 �� Ϊ�˱Ƚ����ַ���Ч���ã���������������µ�ˮ�в������������һ�ַ�����ˮ�в�������� �� �ڶ��ַ�����ˮ�в�������� ��
=85������2.0L��ˮ�����к�I20.020g������CCl4��ȡ�������ַ�����ȡ����һ�ַ�����50mLCCl4��ȡһ�Σ��ڶ��ַ����Ƿ�������ȡ��ÿ����25mLCCl4 �� Ϊ�˱Ƚ����ַ���Ч���ã���������������µ�ˮ�в������������һ�ַ�����ˮ�в�������� �� �ڶ��ַ�����ˮ�в�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�ã���ش��������⣺
��1��a��b������ʱ����Ƭ�Ϸ�����Ӧ�����ӷ���ʽΪ �� ��ʱ����ת����ʽ��Ҫ�ǻ�ѧ��ת��Ϊ�ܣ�
��2��a��b�õ�������ʱ�����·�еĵ����Ǵ����Fe����Cu�����缫���������Cu2+����SO42���������ƶ���ͭ��������Ӧ�ĵ缫��ӦʽΪ ��
��3������Ҫ����Ƭ�϶�һ�����ͭ����a��Ҫ��ֱ����Դ����������������������ӣ���ʱͭƬ�Ϸ����ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þԭ����1s22s22p63s2��1s22s22p63p2ʱ��������ʶ��ȷ����(����)
A.þԭ���ɻ�̬ת���ɼ���̬����һ��������������
B.þԭ���ɼ���̬ת���ɻ�̬����һ�������ͷ�����
C.ת����λ��p�ܼ��ϵ��������Ӵ���ͬһ�����������������ͬ
D.ת����þԭ�����ԭ�ӵ��Ӳ�ṹ��ͬ����ѧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥ�����е�Ca2+��Mg2+��SO ![]() ����ɳ���ɽ���������ˮ��Ȼ���������5��������ٹ��ˣ��ڼӹ���NaOH��Һ���ۼ���������ܼӹ���Na2CO3��Һ���ݼӹ���BaCl2��Һ����ȷ�IJ���˳������ǣ�������
����ɳ���ɽ���������ˮ��Ȼ���������5��������ٹ��ˣ��ڼӹ���NaOH��Һ���ۼ���������ܼӹ���Na2CO3��Һ���ݼӹ���BaCl2��Һ����ȷ�IJ���˳������ǣ�������
A.�ݢڢܢۢ�
B.�ܢ٢ڢݢ�
C.�ڢݢܢ٢�
D.�٢ܢڢݢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com