
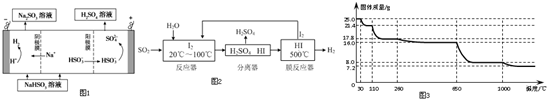
分析 (1)①依据原电池原理,负极是失电子发生氧化反应,二氧化硫失电子生成硫酸的过程;
②根据化合价变化判断阳极反应物质,写出阳极反应式,根据电极方程判断.
(2)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI;
②HI分解是可逆反应,分离出氢气有利于平衡正向移动.
(3)①从还原剂的概念出发分析反应物的价态变化即可;
②从价态变化出发分析得失电子总数解答;
(4)①由图示数据可知,失去水的质量为:25.0g×14.4%=3.6g,根据关系式:CuSO4•5H2O~CuSO4•XH2O利用差量法求出X,从而得出化学式;
②25.0g胆矾的物质的量为0.1mol,650℃~1000℃间所得固体的质量为8.0g,根据Cu元素守恒计算,0.1molCuO的质量为8.0g.
解答 解:①该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
②电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+,生成的H+与HSO3-反应产生SO2;
故答案为:在阳极区HSO3-放电生成H+,H+与HSO3-反应产生SO2;
(2)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI,反应方程式为SO2+I2+2H2O=SO42-+2I-+4H+,故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
②HI分解为可逆反应,及时分离出产物H2,降低生成物浓度,有利于反应正向进行,故答案为:HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
(3)①从反应4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4分析,Cu从+2价变成+1,H从+1价变成-1价,P从+1价变成+5价,还原剂化合价升高,故该反应的还原剂是H3PO2,故答案为:H3PO2;
②Cu从+2价变成+1,4molCu得到4mol电子,H从+1价变成-1价,4mol-1价的H得到8mol电子,共得电子12mol,即每生成4molCuH转移电子12mol,所以每生成1molCuH,转移电子3mol电子,故答案为:3mol;
(4)①CuSO4•5H2O~CuSO4•XH2O△m
250 18(5-x)
25.0g 3.6g
则$\frac{250}{25.0g}$=$\frac{18(5-x)}{3.6g}$,
解得:X=3,所以在110℃时所得固体的成分为CuSO4•3H2O,故答案为:CuSO4•3H2O;
②25.0g胆矾的物质的量为0.1mol,650℃~1000℃间所得固体的质量为8.0g,Cu元素守恒可知,该固体中含有0.1molCu元素,而0.1molCuO的质量为恰好8.0g,所以该固体为CuO,故答案为:CuO.
点评 本题考查了原电池原理和电解池原理的应用、氧化还原反应、有关方程式的计算等,题目难度中等,侧重于考查学生对基础知识的综合应用能力.注意差量法在化学计算中的应用.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
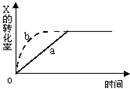 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )| A. | 增大体积 | B. | 增大Y的浓度 | C. | 缩小体积 | D. | 降低温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
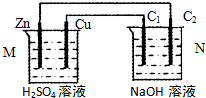
| A. | 工作一段时间后装置M、N中溶液pH均增大 | |
| B. | M装置中H+移向Zn电极 | |
| C. | C2上发生氧化反应 | |
| D. | Cu电极与C1电极发生的电极反应相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的液化过程为物理过程 | |
| B. | 甲烷和乙烯都可以与氯气反应 | |
| C. | 酸性高锰酸钾可以氧化苯和甲烷 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
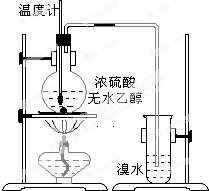 为探究实验室制乙烯及乙烯和溴水的加成反应.甲同学设计了如图所示的实验装置,并进行了实验.当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去.甲同学认为达到了实验目的.
为探究实验室制乙烯及乙烯和溴水的加成反应.甲同学设计了如图所示的实验装置,并进行了实验.当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去.甲同学认为达到了实验目的.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com