
| A. | 2g | B. | 4g | C. | 8g | D. | 10g |
分析 用极端假设法进行分析,假设混合物全部是Mg或全部是铝,根据生成氢气分别计算出它们的质量,混合物的质量介于最大值和最小值之间的值,据此判断.
解答 解:标况下,11.2L氢气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
设要生成0.5mol H2需要Mg的质量为x,则:
Mg+H2SO4═MgSO4+H2↑
24g 1mol
x 0.5mol
解得x=$\frac{24g×0.5mol}{1mol}$=12g
设要生成0.5mol H2 需要铝的质量为y,则:
2Al+3H2SO4═Al2(SO4)3+3H2↑
54g 3mol
y 0.5mol
解得y=$\frac{54g×0.5mol}{3mol}$=9g
所以混合物的质量介于9g~12g之间,
故选:D.
点评 本题考查混合物的有关计算,难度中等,解答本题关键是用极端假设法考虑问题的思路,“极端假设法”是用数学方法解决化学问题的常用方法,可分别假设原混合物是某一纯净物,计算出各自的质量,混合物的质量介于最大值和最小值之间.


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
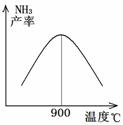 工业合成氨与制备硝酸一般可连续生产,流程如图所示:
工业合成氨与制备硝酸一般可连续生产,流程如图所示: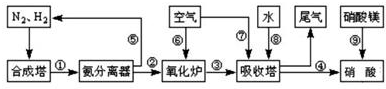
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2X2+3Y2?2X2Y3 | B. | 3X2+2Y2?2X3Y2 | C. | X2+2Y22?XY2 | D. | 2X2+Y2?2X2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 1mol•L-1的溶液中,pH(HCN)>pH(H2CO3)>pH(CH3COOH) | |
| B. | 升高温度,HCN溶液中HCN的电离平衡正向移动,电离平衡常数增大 | |
| C. | 0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比小于2:1 | |
| D. | 饱和H2CO3溶液中c(H+)与c(CO32-)的比值小于2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用SiO2制备硅酸不可能一步完成 | |
| B. | 使用澄清的石灰水可以鉴别Na2CO3和NaHCO3两种白色固体 | |
| C. | 把铁粉和铜粉放入FeCl3溶液充分反应后有固体剩余,固体中可能有铜无铁 | |
| D. | 烧碱溶液应保存在塞有橡胶塞的细口玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类历史上使用最早的合金是青铜 | |
| B. | 目前世界上用量最大的合金是钢 | |
| C. | 改变原料的配比、改变生成合金的条件,可以得到具有不同性质的合金 | |
| D. | 一般合金的熔点高于它的各成分金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl-→SO3-→石墨-→液氧 | B. | NaCl-→乙醇-→铁-→空气 | ||
| C. | 蔗糖-→CuSO4-→氮气-→波尔多液 | D. | KCl-→NaNO3-→氯气-→石灰水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com