
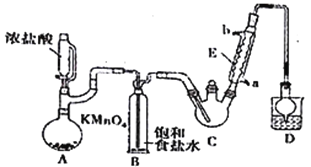
【题目】某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应: C2H5OH+HCl→C2H5Cl+H2O;
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器A中发生反应的化学方程式为_________________________________。
(2)装置B的作用是_________________。该实验在装置中有一处缺陷,即缺少氯气的干燥裝置,缺少该装置可能导致装置C 中副产物______________(填化学式)的量增加;冷凝管的进水口是________(填“a”或“b”);
(3)装置中球形冷凝管的作用是______________________,写出D中所有可能发生的无机反应的离子方程式___________________________________。
(4)反应结束后,从C中的混合物中分离出CCl3COOH的方法是_________________________。
(5)测定产品纯度:称取产品0.50g配成待测溶液,加0.1000 molL-1碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000 molL-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为_____________;(计算结果保留两位有效数字)滴定的反应原理:CCl3CHO+OH-==CHCl3span>+HCOO- HCOO-+I2== H++2I-+CO2↑ I2+2S2O32-==2I-+ S4O62-
(6)为证明三氯乙酸的酸性比乙酸强。某学习小组的同学设计了以下三种方案,你认为能够达到实验目的的是___________。
a.分别测定0.1mol·L-1两种酸溶液的pH,三氯乙酸的pH 较小
b.用仪器测量浓度均为0.1mol·L-1 的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH 较大
【答案】 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 除HCl C2H5Cl 、CCl3COOH a 冷凝回流 Cl2+2OH-= Cl-+ClO-+H2O H++OH-=H2O 蒸馏 53% abc
【解析】本题主要考查对于“模拟工业生产制备三氯乙醛实验”的评价。
(1)仪器A中产生氯气,发生反应的化学方程式为2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。
(2)装置B的作用是除去氯化氢。该实验在装置中有一处缺陷,即缺少氯气的干燥裝置,缺少该装置可能导致装置C中副产物C2H5Cl 、CCl3COOH的量增加;冷凝管的水的流向是“下进上出”,进水口是a;
(3)装置中球形冷凝管的作用是冷凝回流,C中产生的氯化氢和剩余的氯气流向D,D中所有可能发生的无机反应的离子方程式:Cl2+2OH-= Cl-+ClO-+H2O、H++OH-=H2O。
(4)反应结束后,C中液体混合物互溶,所以从C中的混合物中分离出CCl3COOH的方法是蒸馏。
(5)反应“I2+2S2O32-==2I-+ S4O62-”消耗碘的物质的量为0.02000molL-1×0.02000L/2=2.000×10-4mol。
反应“HCOO-+I2== H++2I-+CO2↑”消耗碘的物质的量为0.1000molL-1×0.02000L-2.000×10-4mol=1.800×10-3mol。
产品的纯度为1.800×10-3×147.5/0.50=53%;
(6)为证明三氯乙酸的酸性比乙酸强。能够达到实验目的的是abc。a.同物质的量浓度的三氯乙酸和乙酸溶液,pH越小,酸性越强,故a符合题意;b. 同物质的量浓度的三氯乙酸和乙酸溶液,酸性越强,离子浓度越大,导电性越强,故b符合题意;c.等物质的量浓度的两种酸的钠盐溶液的pH,pH越大,水解程度越大,相应酸的酸性越弱,故选abc。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。

①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学基本概念的说法正确的是
A.在水溶液中能电离出H+的化合物是酸
B.溶液与胶体的本质区别:分散质颗粒的直径大小
C.纯净物与混合物的区别:是否仅含有一种元素
D.根据不同的物质分类标准,纯碱可归类为碱、钠盐、碳酸盐等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气的叙述正确的是
A.铁丝在氯气中燃烧生成FeCl2
B.红热的铜丝在氯气中剧烈燃烧,产生棕黄色的烟
C.氯气、液氯和氯水都是纯净物,都有漂白性
D.用氯气对生活用水进行消毒的原因是氯气本身能杀灭细菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置做相应实验,收集方法及所加试剂、现象、结论均正确的是
选项 | 气体 | 试剂 | 现象 | 结论 |
|
A | X | 酸性KMnO4溶液 | 溶液褪色 | X一定是SO2 气体 | |
B | NH3 | 酚酞溶液 | 溶液变红色 | 氨水呈碱性 | |
C | NO2 | 淀粉一KI溶液 | 溶液变蓝色 | NO2有还原性 | |
D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水有酸性和漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
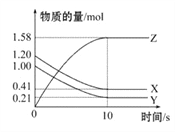
A. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 10 s后,该反应停止进行
C. 反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
D. 0~10 s的时间内的平均反应速率:v(X)=v(Y)=0.0395 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合如图图象的是( ) 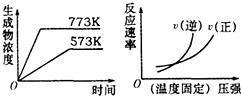
A.N2(g)+3H2(g)2NH3(g);△H=﹣Q1kJmol﹣1 (Q1>0)
B.2SO3(g)2SO2(g)+O2(g);△H=+Q2kJmol﹣1 (Q2>0)
C.4NH3(g)+5O2(g)4NO(g)+6H2O(g);△H=﹣Q3kJmol﹣1(Q3>0)
D.H2(g)+CO(g)C(s)+H2O(g);△H=+Q4kJmol﹣1﹣1(Q4>0)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com