
关于氢键,下列说法正确的是
A.含氢元素的化合物中一定有氢键
B.因为氢键的缘故,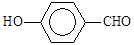 比
比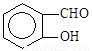 熔沸点高
熔沸点高
C.由于氢键比范德华力强,所以H2O分子比H2S分子稳定
D.“可燃冰”——甲烷水合物(例如:8CH4·46H2O)中CH4与H2O之间存在氢键
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下:
超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下:
2- 3 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012届河北省高二3月份月考化学试卷 题型:选择题
某有机物X加氢反应后的还原产物是CH3CH(CH3)CH2OH,关于X的下列说法正确的是
A.X可能是乙醛的同系物 B.X可能是正丁醇的同分异构体
C.X可能是乙烯的同分异构体 D.X分子中可能有碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com