
分析 (1)由HA-?H++A2-可知,Na2A为强碱弱酸盐;0.1mol•L-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,0.1mol•L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离;
(2)该温度下水的离子积为1×10-12,据此计算出pH=11、pH=2、pH=2的溶液中氢氧根离子、氢离子浓度,然后列式计算即可.
(3)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3•H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$;
(4)向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,NaCN水解程度比大CH3COONa,结合溶液电中性原则分析.
解答 解:(1)由HA-?H++A2-可知,Na2A为强碱弱酸盐,A2-水解的离子反应为:A2-+H2O?HA-+OH-,导致溶液显示碱性;
0.1mol•L-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,0.1mol•L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L=0.11mol/L,
故答案为:碱性;<;0.1 mol•L-1NaHB 溶液的pH=2,说明其中c(H+)=0.01 mol•L-1,主要是HB-电离产生的,在H2B溶液中,第一步电离产生的H+抑制了第二步的电离,所以0.1mol•L-1 H2B 溶液中c(H+)<0.11 mol•L-1;
(2)该温度下水的离子积为Kw=1×10-12,将pH=11的苛性钠中氢氧根离子浓度为:c(OH-)=$\frac{1×1{0}^{-12}}{1×1{0}^{-11}}$mol/L=0.1mol/L,pH=1的稀硫酸中氢离子浓度为0.1mol/L,
pH=2的溶液中氢离子浓度为0.01mol/L,则混合液中满足:0.1mol/L×V2-0.1mol/L×V1=0.01mol/L×(V1+V2),
整理可得:V1:V2=9:11,
故答案为:9:11;
(3)反应平衡时溶液中c(NH4+)=c(Cl-),则溶质为NH4Cl 和NH3•H2O;
平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3•H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}×0.005}{0.5a-0.005}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:NH4Cl 和NH3•H2O;$\frac{1{0}^{-9}}{a-0.01}$;
(4)HCN的酸性比CH3COOH的酸性弱,由越弱越水解知,醋酸钠的水解程度小于氢氰酸钠的水解程度,CN-+H2O?HCN+OH-,CH3COO-+H2O?CH3COOH+OH-,CH3COONa溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-),NaCN溶液中c(Na+)+c(H+)=c(CN-)+c(OH-),钠离子的浓度不变且相等,CN-的水解程度较大,溶液中OH-的浓度较大,H+的浓度较小,故阳离子的浓度之和较小,则CH3COONa溶液中阴离子的总物质的量大于NaCN,即:n1>n2,
故答案为:>.
点评 本题考查了离子浓度大小比较、溶解酸碱性与溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫 | B. | 氮的氧化物 | C. | 二氧化碳 | D. | 臭氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料 | |
| D. | 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝比铁更耐酸碱的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
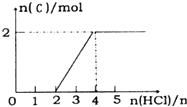 A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题: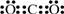 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 五种 | B. | 四种 | C. | 三种 | D. | 二种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

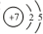 ,其单质的电子式为
,其单质的电子式为 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体可能是甲烷和乙烯 | ||
| C. | 混合气体中一定有乙烷 | D. | 混合气体可能是乙烯和乙炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com