
科目:高中化学 来源: 题型:
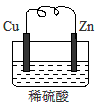
 由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36L(标准状况)的气体.问:
由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36L(标准状况)的气体.问:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年北京市八一中学高一第二学期期末考试化学试卷 题型:填空题
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH + HCl =" NaCl" + H2O,
B.2FeCl3 + Cu = 2FeCl2 + CuCl2
判断能否设计成原电池A. B. 。(填“能”或“不能”)
(2)由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生原电池腐蚀,一段时间后某电极产生3.36L标准状况下的气体。
①负极是 (填“锌”或“铜”),发生 反应(填“氧化”或“还原”);
②正极的电极反应式为 ;
③产生这些气体共需转移电子 mol。
查看答案和解析>>
科目:高中化学 来源:2010年吉林省高一下学期期末考试化学试题 题型:填空题
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH + HCl = NaCl + H2O,
B.2FeCl3 + Cu = 2FeCl2 + CuCl2
判断能否设计成原电池A. B. 。(填“能”或“不能”)
(2)由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生原电池腐蚀,一段时间后某电极产生3.36L标准状况下的气体。
①负极是 (填“锌”或“铜”),发生 反应(填“氧化”或“还原”);
②正极的电极反应式为 ;
③产生这些气体共需转移电子 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com