
【题目】实验室以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7的主要流程如图:
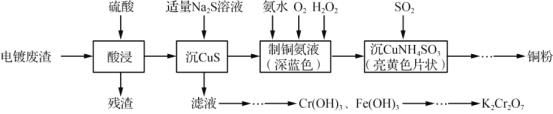
(1)“酸浸”时,所得残渣的主要成分是___________。
(2)“沉 CuS”时,加入的硫化钠必须适量,若过量可能产生的后果是_________(用离子方程式表示)。
(3)一水合硫酸四氨合铜加热到650℃可分解为铜、氨气、二氧化硫和水以及一种无污染气体,写出其化学方程式___________。
(4)“沉CuNH4 SO3”时可用如图装置(夹持、加热仪器略):
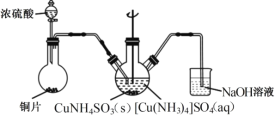
①“沉CuNH4SO3”时,反应液需控制在45℃,合适的加热方式是____________。
②NaOH溶液的作用是___________。
(5)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.0g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L–1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2O72-被还原为Cr3+)
①若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品K2Cr2O7的纯度为_____%。[已知M(K2Cr2O7)=294g·mol-1,计算结果保留至小数点后两位]。
②上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的 Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=2×10–5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全?____________(通过计算说明原因)。{已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
【答案】CaSO4 Fe3++S2–==2Fe2++S↓、Fe2++S2-=FeS↓ 3[Cu(NH3)4]SO4·H2O![]() 3Cu+2N2↑+8NH3↑+3SO2↑+9H2O↑ 45℃的水浴加热 吸收SO2,防止污染空气 61.25% Cr(OH)3开始出现沉淀时,溶液中
3Cu+2N2↑+8NH3↑+3SO2↑+9H2O↑ 45℃的水浴加热 吸收SO2,防止污染空气 61.25% Cr(OH)3开始出现沉淀时,溶液中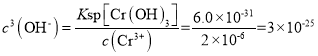 ,Fe3+沉淀完全,c(Fe3+)应小于10-5mol/L,Fe(OH)3沉淀完全时,溶液中
,Fe3+沉淀完全,c(Fe3+)应小于10-5mol/L,Fe(OH)3沉淀完全时,溶液中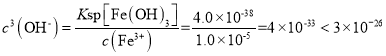 ,说明Fe3+沉淀完全
,说明Fe3+沉淀完全
【解析】
分析流程图,电镀废渣用硫酸酸浸,残渣为与硫酸反应后的难溶物或微溶物,结合电镀废渣的成分可分析出残渣主要成分。向滤液中加入适量硫化钠溶液,进行沉CuS,可知主要发生Cu2++S2-=CuS↓的反应,过滤后滤液和滤渣经不同方式处理。滤液中主要含有Fe3+和Cr3+,经一系列处理,将Fe3+和Cr3+转化为Cr(OH)3和Fe(OH)3,结合题意,根据二者的溶度积的差异,除去Fe(OH)3,Cr(OH)3经过一系列变化最终得到K2Cr2O7。向滤渣中加入氨水、O2和H2O2,制深蓝色的铜氨液,后向铜氨液中加入SO2得到亮黄色片状的沉CuNH4 SO3,最终经一系列变化得到铜粉。据此进行分析。
(1)电镀废渣(Cr2O3、CuO、Fe2O3及CaO)用硫酸酸浸,残渣为CaSO4等溶解度不大的物质;答案为:CaSO4;
(2)溶液中有Cr3+、Cu2+、Fe3+,加适量Na2S溶液,过滤后,滤液中含有Cr3+、Fe3+,经处理后生成Fe(OH)3、Cr(OH)3。若Na2S溶液过量,可能发生2Fe3++S2-=2Fe2++S↓,再过量,S2-和Fe2+继续产生沉淀FeS,发生的反应为:Fe2++S2-=FeS↓;答案为:Fe3++S2–==2Fe2++S↓、Fe2++S2-=FeS↓;
(3根据题给信息以及原子守恒可写出该化学反应方程式为:3[Cu(NH3)4]SO4·H2O![]() 3Cu+2N2↑+8NH3↑+3SO2↑+9H2O↑;答案为:3[Cu(NH3)4]SO4·H2O
3Cu+2N2↑+8NH3↑+3SO2↑+9H2O↑;答案为:3[Cu(NH3)4]SO4·H2O![]() 3Cu+2N2↑+8NH3↑+3SO2↑+9H2O↑;
3Cu+2N2↑+8NH3↑+3SO2↑+9H2O↑;
(4)①要控制100℃以下的加热温度,且受热均匀,可选用水浴加热,沉CuNH4SO3时,反应需控制在45℃,则合适的加热方式为:45℃的水浴加热;答案为:45℃的水浴加热;
②二氧化硫污染空气,必须吸收,故NaOH溶液的作用是吸收SO2,防止其污染空气;答案为:吸收SO2,防止污染空气;
(5)①Cr2O72-作氧化剂,把Fe2+氧化成Fe3+,+6价Cr被还原成Cr3+,反应的离子方程式为:Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O,根据离子反应方程式得:K2Cr2O7的纯度=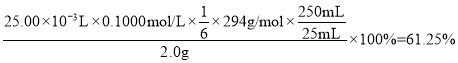 ;答案为:61.25%;
;答案为:61.25%;
②当溶液中Cr(OH)3开始出现沉淀时,溶液中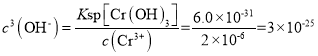 ,Fe3+沉淀完全,c(Fe3+)应小于10-5mol/L,Fe(OH)3沉淀完全时,溶液中
,Fe3+沉淀完全,c(Fe3+)应小于10-5mol/L,Fe(OH)3沉淀完全时,溶液中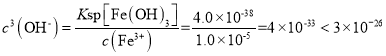 ,说明Fe3+沉淀完全。
,说明Fe3+沉淀完全。


科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为C9H10O2,试回答下列有关问题。
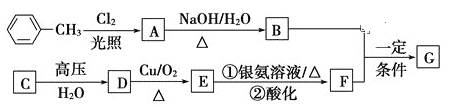
(1)G的结构简式为_________。
(2)指出下列反应的反应类型:A转化为B:________,C转化为D:__________。
(3)写出下列反应的化学方程式
D生成E的化学方程式:___________________________________________________。
A生成B的化学方程式:___________________________________________________。
B和F生成G的化学方程式:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2009年《化学教育》期刊封面刊载如图所示的有机物M(只含C、H、O)的球棍模型图。不同大小、颜色的小球代表不同的原子,小球之间的“棍”表示共价键,既可以表示三键,也可以表示双键,还可以表示单键。下列有关M的推断正确的是( )

A. M的分子式为C12H12O2
B. M与足量氢气在一定条件下反应的产物的环上一氯代物有7种
C. M能发生中和反应、取代反应
D. 一个M分子最多有11个原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g);ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g);ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g);ΔH3=-221 kJ·mol-1
反应2NO(g)+2CO(g)N2(g)+2CO2(g)的ΔH=________ kJ·mol-1。
(2)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:

①n(NH3)∶n(NO)的物质的量之比为1∶3时,对应的是曲线________(填“a”“b”或“c”)。
②由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是____________。
(3)NO氧化反应:2NO(g)+O2(g)2NO2(g)分两步进行,其反应过程能量变化示意图如图:
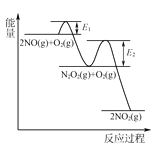
Ⅰ. 2NO(g)→N2O2(g);ΔH1
Ⅱ. N2O2(g)+O2(g)→2NO2(g);ΔH2
①化学反应速率有速率较慢的反应步骤决定。以上反应决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
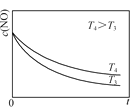
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因:______。
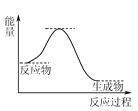
(4) NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图:
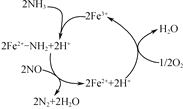
研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图,写出脱硝过程的总反应方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图示的分析中,不正确的是( )
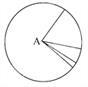

A. 如果该图为组成活细胞中的元素,则A是氧元素
B. 如果该图表示的是组成细胞的化合物,则A是蛋白质
C. 如果该图表示的是活细胞中的元素,则其中Mo的含量很少
D. 如果该图为组成细胞的有机化合物,则A中肯定含有的元素为C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍及化合物在机械制造、磁性材料、新型电池或高效催化剂等许多领域都有着广泛的应用。请回答下列问题:
(1)基态Ni原子核外的最高能层符号是______,基态Ni2+最外层电子排布式为_______,未成对电子数为________________。
(2)[Co(NO![]() )4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
)4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
(3)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如图所示:
①上述三种晶体的晶胞中属于体心立方晶胞的是______(填“α”“δ”或“γ”)-Fe。
②γ-Fe晶胞中铁原子的配位数为_______________。
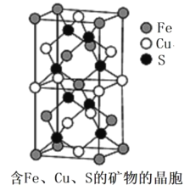
(4)一种含有Fe、Cu、S 三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为Apm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________g/cm3(写出表达式)。
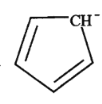
(5)二茂铁[(C5H5)2Fe]可用作火箭燃料添加剂、汽油抗爆剂。二茂铁熔点172℃,沸点249℃,易升华,难溶于水,易溶于有机溶剂,它属于__________晶体。分子中的大π键可用符号![]() 表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H
表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H![]() )结构如图所示,其中的大π键可以表示为_______。
)结构如图所示,其中的大π键可以表示为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用CuSi合金作硅源,在950℃利用三层液熔盐进行电解精炼,下列说法正确的是( )
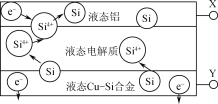
A.X与电源的正极相连
B.电子能够在三层液熔盐间自由流动
C.电子由液态CuSi合金流出
D.在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原理如图所示:
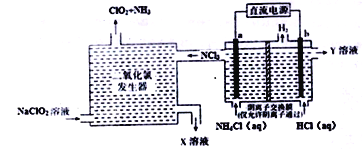
下列说法不正确的是
A. b电极接电源的负极,在b极区流出的Y溶液是稀盐酸
B. 二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
C. 电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则b极产生0.6gH2
D. 电解池a极的电极反应式为NH4+-6e-+4OH-+3Cl-=NCl3+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研工作者近期提出肉桂硫胺(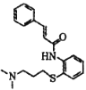 )可能对 2019- nCoV有疗效。肉桂硫胺的合成路线如图:
)可能对 2019- nCoV有疗效。肉桂硫胺的合成路线如图:

已知:
①
![]()
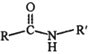
②R-NO2![]() R-NH2
R-NH2
完成下列问题
(1)F的结构简式为__________。G→H 的反应类型是____________。
(2)E中的所含官能团名称为______________。
(3)B→C反应试剂及条件为_______________ 。
(4)有机物 D 与新制氢氧化铜悬浊液(加热)的反应方程式为_________。
(5)J为 E的同分异构体,写出符合下列条件的J 的结构简式_______(写两种)。
①能发生银镜反应
②J 是芳香族化合物,且苯环上的一氯代物只有两种
③核磁共振氢谱有 5 组峰,且峰面积之比为 2 :2 :2 :1 :1
(6)参照上述合成路线及已知信息,写出由甲苯和丙酰氯(CH3CH2COCl) 为原料合成 的路线:___________。
的路线:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com