
火力发电厂释放出大量二氧化碳,对燃煤废气进行脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。将CO2转化为甲醇是一种新型脱碳技术,其反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH。
(1)取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图Ⅰ所示,则上述CO2转化为甲醇的反应的ΔH________0(填“>”、“<”或“=”)。
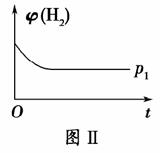

(2)如图Ⅱ是在恒温密闭容器中,压强为p1时H2的体积分数随时间t的变化曲线,请在图中画出该反应在p2(p2>p1)时H2的 体积分数随时间t的变化曲线。
(3)在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的物质的量浓度随时间的变化如图Ⅲ所示。

则0~10 min内,氢气的平均反应速率为________;该温度下,反应的平衡常数为________(保留三位有效数字);10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数________(填“增大”、“减小”或“不变”)。
解析 (1)反应达到平衡后,升高温度,甲醇的体积分数减小,说明正反应是放热反应,ΔH<0。(2)在恒温密闭容器中,CO2(g)+3H2(g)CH3OH(g)+H2O(g)是气体总体积减小的反应,加压平衡向正反应方向移动,氢气的体积分数减小,p2下达到平衡所需的时间也比p1短,据此可画出相应曲线。(3)0~10 min内,氢气的平均反应速率为v(H2)=3v(CO2)=3× =0.255 mol·L-1·min-1;该温度下,反应的平衡常数K=
=0.255 mol·L-1·min-1;该温度下,反应的平衡常数K=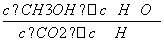 =
=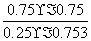 =5.33;反应达到平衡后,向该容器中再充入1 mol CO2和3 mol H2,相当于增大压强,平衡向正反应方向移动,甲醇的体积分数增大。
=5.33;反应达到平衡后,向该容器中再充入1 mol CO2和3 mol H2,相当于增大压强,平衡向正反应方向移动,甲醇的体积分数增大。
答案 (1)< (2)
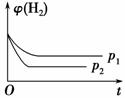
(3)0.225 mol·L-1·min-1 5.33 增大


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列叙述正确的是 ( )。
A.金属受外力作用时常常发生变形而不易折断,是由于金属原子之间有较
强的作用
B.通常情况下,金属里的自由电子会发生定向移动而形成电流
C.金属是借助自由电子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
有关天然产物水解的叙述不正确的是( )
A.油脂水解可得到丙三醇
B.可用碘检验淀粉水解是否完全
C.蛋白质水解的最终产物均为氨基酸
D.纤维素水解与淀粉水解得到的最终产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) ΔH>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是 ( )。

| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一反应:2A+B2C,其中A、B、C均为气体,右图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是 ( )。
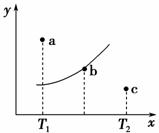
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,下列说法不正确的是 ( )。

A.反应过程(1)的热化学方程式为 A2 (g)+B2(g)===C(g) ΔH1=-Q kJ·mol-1
B.反应过程(2)的热化学方程式为C(g)===A2(g)+B2(g) ΔH2=+Q1 kJ·mol-1
C.Q与Q1的关系:Q>Q1
D.ΔH2>ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程中的能量关系可用右图简单表示(图中的ΔH表示生成
1 mol产物的数据)。

(1)写出表示S8燃烧热的热化学方程式________________________________
________________________________________________________________。
(2)写出SO3分解生成SO2和O2的热化学方程式_________________________
_________________________________________________________________。
(3)若已知1个S8分子中有8个硫硫键,硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
选用下列试剂和电极:稀 H2 SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计Ⓖ的指针均明显偏转,则其可能的组合共有 ( )。
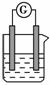
A.6种 B.5种
C.4种 D.3种
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.1.2 g金刚石中含有的碳碳单键数为0.4NA
B.4.4 g二氧化碳中含有的共用电子对数为0.4NA
C.常温时11.2 L乙烯在氧气中完全燃烧转移的电子数为6.0NA
D.常温下0.1 mol·L-1硝酸铵溶液中,NH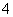 和H+总数一定大于0.1NA
和H+总数一定大于0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com