
【题目】下列说法正确的是
A. 石油分馏可以获得乙烯
B. 煤经过气化和液化等物理变化可转化为淸洁燃料
C. 聚乙烯塑料制品可用于食品包装
D. 天然气和液化气的主要成分都是甲烷
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】下列同一组反应的反应类型,不相同的是
A.1-丁烯使溴水褪色,乙炔制取氯乙烯
B.苯乙烯制取聚苯乙烯,四氟乙烯制取聚四氟乙烯
C.1-己烯使KMnO4酸性溶液褪色,甲苯使KMnO4酸性溶液褪色
D.由氯代环己烷制环己烯;由丙烯制1,2-二溴丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3以及少量Fe、Si的化合物。可以用孔雀石为原料制备胆矾(CuSO4·5H2O) 步骤如下:
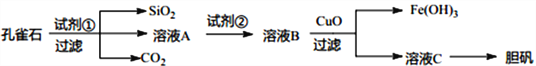
请回答下列问题:
(1)试剂①是一种常见的酸,写出其化学式__________。过滤所需要的玻璃仪器有__________。
(2)实验室检验Fe3+的常用方法是________________。
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+,从而形成溶液B,则试剂②能否用氯水________________(填“能”或“不能”若“不能”,请解释原因)。
(4)由溶液C获得胆矾,需要经过________、__________、过滤等操作。
(5)取25.00mL溶液A,用1.000×10-2mol/LKMnO4标准溶液滴定。反应离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O,若消耗标准溶液20.00mL,则溶液A中Fe2+的浓度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A.-488.3 kJ/mol B.+488.3 kJ/mol
C.-191 kJ/mol D.+191 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2。符合上述转化关系的A、C可能是

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2
A.只有②③④⑥ B.除①外 C.除⑤外 D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且![]() 的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
A. 若某温度下,反应后![]() =11,则溶液中
=11,则溶液中
B. 参加反应的氯气的物质的量等于0. 5amol
C. 改变温度,反应中转移电子的物质的量ne的范围:![]() amol≤ne≤
amol≤ne≤![]() amol
amol
D. 改变温度,产物中KC1O3的最大理论产量为![]() amol
amol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是___________ (用化学式填写)。
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为___________________________。
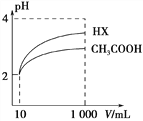
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+)___醋酸溶液中水电离的c(H+) ;电离常数Ka(HX)___Ka(CH3COOH)(填“>”、“=”或“<”)。
(3)CO32- 、 NO2- 、CN-、CH3COO-结合H+的能力由强到弱的顺序为_______________________(用离子符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、1.01×105Pa下,将22gCO2通入到750mL1.0mol/L的NaOH溶液中充分反应,放出xkJ热量。已知该条件下,1mol CO2通入到2L1.0mol/LNaOH溶液中充分反应,放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确为
A. CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ/mol
B. CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ/mol
C. CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2x-y)kJ/mol
D. CO2(g)+NaOH(aq)=2NaHCO3(aq)△H=-(8x-2y)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016天津)下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:__________。
(5)碳与镁形成的1mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L2.2 mol/L NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com