
一定温度下,在容积为2 L的密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g),部分数据见下表(表中t2>t1)。
CO2(g)+H2(g),部分数据见下表(表中t2>t1)。
反应时间/min | 0 | t1 | t2 |
n(CO)/mol | 1.20 | 0.80 | |
n(H2O)/mol | 0.60 | 0.20 | |
n(CO2)/mol | 0 | ||
n(H2)mol | 0 |
下列说法正确的是
A.反应在t1 min内的平均速率为v(H2)=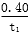 mol·L-1·min-1
mol·L-1·min-1
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20 mol
科目:高中化学 来源:2016-2017学年浙江省嘉兴市七校高一上期中化学试卷(解析版) 题型:选择题
与100 mL 0.5 mol/L NaCl溶液中的Cl-的物质的量浓度相同的是( )
A.100 mL 0.5 mol/L MgCl2溶液 B.200 mL 0.25 mol/L KCl溶液
C.100 mL 0.5 mol/L HCl溶液 D.100 mL 0.5 mol/L NaClO溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市红桥区高一上学期期中化学试卷(解析版) 题型:选择题
配制0.1mol•L﹣1NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是( )
A.称量时,左盘低,右盘高 B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥 D.定容时液面超过了刻度线
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市红桥区高一上学期期中化学试卷(解析版) 题型:选择题
下列表格中除去括号内的杂质,所选试剂和操作方法均正确的是( )
A | KCl(BaCl2) | 加过量K2CO3溶液后过滤,再蒸干滤液. |
B | NaNO3(AgNO3) | 加足量NaCl溶液后过滤,再蒸馏滤液. |
C | NaCl溶液(I2) | 加足量酒精后萃取分液 |
D | KNO3溶液(CCl4) | 直接进行分液操作. |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市河东区高二上学期期中质检化学试卷(解析版) 题型:填空题
工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)在—定温度和压强下,CO(g)+2H2(g) CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为____________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是____________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度____________(填“增大”、“不变”或“减小”)。
CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为____________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是____________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度____________(填“增大”、“不变”或“减小”)。
(2)判断该反应达到平衡状态的依据是____________(填字母序号)。
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
E.CH3OH、CO、H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
平衡 时数据 | 反应能量变化的绝对值(kJ) | a | b | c |
反应物转化率 | α1 | α2 | α3 | |
则a+b=________;a1+a3________1(填“<”、“>”或“=”,)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市河东区高二上学期期中质检化学试卷(解析版) 题型:选择题
已知反应:2NO(g)+Br2(g)=2NOBr(g)的活化能为a kJ/mol,其反应机理如下:
①NO(g)+Br2(g)=NOBr2(g) 慢
②NO(g)+NOBr2(g)=2NOBr(g) 快
下列有关该反应的说法正确的是
A.反应的速率主要取决于②的快慢 B.反应速率v(NO)=v(NOBr)=2v(Br2)
C.NOBr2是该反应的催化剂 D.该反应的焓变等于a kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市河东区高二上学期期中质检化学试卷(解析版) 题型:选择题
下列说法正确的是
A.甲烷燃烧热的数值为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的中和热为57.4 kJ/mol
C.相同条件下,2 mol氢原子所具有的能量小于1 mol氢分子所具有的能量
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上月考三化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是( )
A.Cu溶于稀HNO3:Cu+2H++NO3-===Cu2++NO2↑+H2O
B.工业冶炼金属钠:2NaCl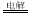 2Na+Cl2↑
2Na+Cl2↑
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
D.向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学卷(解析版) 题型:选择题
金属铬和氢气在工业上都有重要的用途。已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4)。铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是
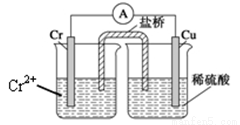
A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论 上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com