
| A、用500mL容量瓶配制450mL 0.1 moL/L的氢氧化钠溶液,用托盘天平称取氢氧化钠固体1.8g |
| B、用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中 |
| C、用量筒量取浓硫酸时,仰视读数 |
| D、其它环节正确,只是在定容时俯视容量瓶 |
| n |
| V |


科目:高中化学 来源: 题型:
| A、引起空气发生化学变化 |
| B、产生杀菌消毒作用 |
| C、诱发动植物的基因突变 |
| D、造成病毒感染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
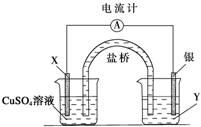 根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:
根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| C(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
| 实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
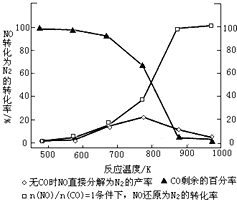 汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图.
汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图.查看答案和解析>>
科目:高中化学 来源: 题型:
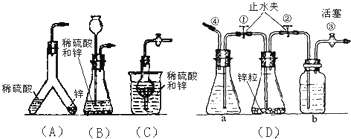
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合物中Cu和O的物质的量之比为2:1 |
| B、硝酸的物质的量浓度为2.6mol/L |
| C、产生的NO在标准状况下的体积为4.48L |
| D、Cu、CuO、Cu2O与硝酸反应后剩余HNO3为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com