
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) =Si3N4(s)+12HCl(g)+Q(Q>0)完成下列填空:
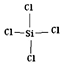
(1)写出N2的电子式:___________________,写出SiCl4的结构式:______________。
(2)由氮化硅(Si3N4)陶瓷的用途可推测其晶体类型为________。
a.离子晶体 b. 原子晶体 c.分子晶体 d.金属晶体
(3)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率___ mol/(L·min)。
(4)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是______。
a.3v逆(N2)=v正(H2) b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变 d.c(N2):c(H2):c(HCl)=1:3:6
(5)上述反应达到平衡后,下列说法正确的是________。
a.其他条件不变,压强增大,正反应速率减小
b.其他条件不变,温度升高,正、逆反应速率都增大
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(6)若平衡时H2和HCl的物质的量之比为![]() ,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___
,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___![]() (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
【答案】 ![]()
 b 0.02 ac bd <
b 0.02 ac bd <
【解析】(1)本题考查电子式和结构式的书写,N2中两个氮原子共用叁键,即电子式为:![]() ,SiCl4中Si与4个Cl形成单键,即结构式为:
,SiCl4中Si与4个Cl形成单键,即结构式为: ;(2)考查晶体的类型,根据Si3N4的特点:耐热说明熔点高,这是原子晶体的特点,因此Si3N4属于原子晶体,故b正确;(3)考查化学反应速率的计算,固体质量增加2.8g,说明生成Si3N4的质量为2.8g,即物质的量为2.8/140mol=0.02mol,根据反应方程式,消耗氢气的物质的量为0.02×6mol=0.12mol,根据化学反应速率的数学表达式,v(H2)=0.12/(2×3)mol/(L·min)=0.02 mol/(L·min);(4)考查化学平衡状态的判断,a、要求两个速率的方向是一个向正反应方向进行,一个向逆反应方向进行,且它们的速率之比等于化学计量数之比,v逆(N2)说明反应向逆反应方向进行,v正(H2)说明反应向正反应方向进行,v逆(N2):v正(H2)=1:3,等于其化学计量数之比,说明反应达到平衡,故a正确;b、类似选项a的分析,不能说明反应达到平衡,故b错误;c、Si3N4为固体,其余为气体,根据质量守恒,气体质量减少,容器是恒容状态,气体体积不变,因此当密度不再改变,说明反应达到平衡,故c正确;d、没有给出反应起始时的投入量,无法判断是否达到平衡,故d错误;(5)考查影响化学反应速率的因素和化学平衡移动的因素,a、增大压强,化学反应速率增大,故a错误;b、升高温度,正逆反应速率加快,故b正确;c、Si3N4是固体,浓度视为常数,增加Si3N4的量,平衡不移动,故c错误;d、HCl是气体,增加HCl的量,平衡向逆反应方向进行,故d正确;(6)考查影响化学平衡移动的因素,此反应是放热反应,降低温度,平衡向正反应方向进行,H2量减少,HCl的量增加,因此此比值减小,即填“<”。
;(2)考查晶体的类型,根据Si3N4的特点:耐热说明熔点高,这是原子晶体的特点,因此Si3N4属于原子晶体,故b正确;(3)考查化学反应速率的计算,固体质量增加2.8g,说明生成Si3N4的质量为2.8g,即物质的量为2.8/140mol=0.02mol,根据反应方程式,消耗氢气的物质的量为0.02×6mol=0.12mol,根据化学反应速率的数学表达式,v(H2)=0.12/(2×3)mol/(L·min)=0.02 mol/(L·min);(4)考查化学平衡状态的判断,a、要求两个速率的方向是一个向正反应方向进行,一个向逆反应方向进行,且它们的速率之比等于化学计量数之比,v逆(N2)说明反应向逆反应方向进行,v正(H2)说明反应向正反应方向进行,v逆(N2):v正(H2)=1:3,等于其化学计量数之比,说明反应达到平衡,故a正确;b、类似选项a的分析,不能说明反应达到平衡,故b错误;c、Si3N4为固体,其余为气体,根据质量守恒,气体质量减少,容器是恒容状态,气体体积不变,因此当密度不再改变,说明反应达到平衡,故c正确;d、没有给出反应起始时的投入量,无法判断是否达到平衡,故d错误;(5)考查影响化学反应速率的因素和化学平衡移动的因素,a、增大压强,化学反应速率增大,故a错误;b、升高温度,正逆反应速率加快,故b正确;c、Si3N4是固体,浓度视为常数,增加Si3N4的量,平衡不移动,故c错误;d、HCl是气体,增加HCl的量,平衡向逆反应方向进行,故d正确;(6)考查影响化学平衡移动的因素,此反应是放热反应,降低温度,平衡向正反应方向进行,H2量减少,HCl的量增加,因此此比值减小,即填“<”。


科目:高中化学 来源: 题型:
【题目】I.请根据化学反应与热能的有关知识,填写下列空白:
(1)下列反应中,属于吸热反应的是_________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③铝粉与氧化铁粉末在高温下反应
④酸碱中和反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)已知H2和O2反应放热,且断开1molH-H、1mo1O=O、1molO-H键需吸收的能量分别为Q1kJ、Q2kJ、Q3kJ,由此可以推知下列关系正确的是______(填字母编号)。
A. Q1+ Q2> Q3 B. 2Q1+ Q2<4 Q3 C. Q1+Q2>2Q3 D. 2Q1+Q2<2Q3
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和______(填“大于”“小于”或“等于”)反应物的能量总和。
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量_______(填“>”“<”或“=”)572KJ。
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式:____________________________________。
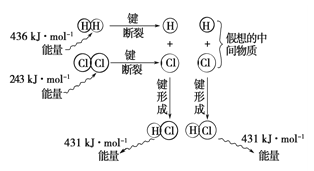
(6)观察下图,计算1molH2与1molCl2反应_______(“吸收”或“释放”)的能量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各原子或离子的电子排列式错误的是
A. Na+1s22s22p6 B. F-1s22s22p6
C. N3+ 1s22s22p6 D. O2-1s22s22p6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是__________(填“增大”、“减小”或“不变”,下同),ΔH的变化是__________。请写出NO2和CO反应的热化学方程式___________________。

(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为_______________。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |

已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=__________ kJ·mol-1(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硝酸厂处理尾气中NO的方法是在催化剂存在时用H2将NO还原为N2:NO(g)+H2(g)=== ![]() N2(g)+H2O(g) ΔH=m kJ·mol-1,其能量变化过程如下:
N2(g)+H2O(g) ΔH=m kJ·mol-1,其能量变化过程如下:
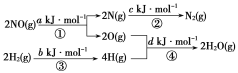
下列说法正确的是( )
A.过程①②③④都是放热过程
B.m=+![]() (a+b-c-d)
(a+b-c-d)
C.m=-![]() (c+a-d-b)
(c+a-d-b)
D.m=![]() (c+d-a-b)
(c+d-a-b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.SO2常用于纸张等植物纤维的漂白
B.工业上可用铝热反应大规模炼铁
C.光导纤维的主要成允是SiO2
D.电解熔融MgCl2 , 可制得金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com