
 甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.
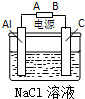
甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.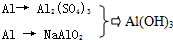
分析 甲:可溶性铝盐与氨水反应可以获得氢氧化铝沉淀,离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
乙:(1)铝单质转化为氢氧化铝中+3价的铝是发生氧化反应,铝单质是阳极,所以A是正极;铝电极的电极反应式为:Al-3e-=Al3+;
(2)氯化钠组成中各离子未参与电极反应,所以其作用是增强溶液的导电性;
丙:(1)生成1mol的氢氧化铝,Ⅰ中消耗1.5mol的硫酸、3mol的氢氧化钠和1mol的铝;
Ⅱ消耗0.5mol的硫酸、1mol的氢氧化钠和1mol的铝;Ⅲ中消耗0.375mol的硫酸、0.75mol的氢氧化钠;综上所述Ⅲ中节省原料;
(2)①根据实验操作步骤以及玻璃仪器的作用选取仪器;
②除去铝粉表面的氧化膜;
③根据Al3++3AlO2-+6H2O=4Al(OH) 3↓,可知与酸反应的铝占整个铝的$\frac{1}{4}$;
④铝与氢氧化钠反应生成偏铝酸钠与氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
⑥Al(OH)3的产率是$\frac{实际产量}{理论产量}×100%$.
解答 解:甲:可溶性铝盐与氨水反应可以获得氢氧化铝沉淀,离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
乙:(1)铝单质转化为氢氧化铝中+3价的铝是发生氧化反应,铝单质是阳极,所以A是正极;铝电极的电极反应式为:Al-3e-=Al3+,故答案为:Al-3e-=Al3+;
(2)氯化钠组成中各离子未参与电极反应,所以其作用是增强溶液的导电性,故答案为:增强导电能力;
丙:(1)生成1mol的氢氧化铝,Ⅰ中消耗1.5mol的硫酸、3mol的氢氧化钠和1mol的铝;
Ⅱ消耗0.5mol的硫酸、1mol的氢氧化钠和1mol的铝;Ⅲ中消耗0.375mol的硫酸、0.75mol的氢氧化钠;综上所述Ⅲ中节省原料,
故答案为:Ⅲ;
(2)①托盘天平(含砝码)、烧杯、玻璃棒、500 mL容量瓶、胶头滴管,故答案为:500 mL容量瓶、胶头滴管;
②烧杯A中加入50mL 0.5mol•L-1NaOH溶液,再加入足量铝屑给溶液稍加热是除去铝粉表面的Al2O3,故答案为:除去铝粉表面的Al2O3;
③根据Al3++3AlO2-+6H2O=4Al(OH) 3↓,可知与酸反应的铝占整个铝的$\frac{1}{4}$,所以在盛有适量稀H2SO4的烧杯B中放入$\frac{{m}_{1}}{4}$,故答案为:$\frac{{m}_{1}}{4}$;
④铝与氢氧化钠反应生成偏铝酸钠与氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
⑥Al(OH)3的产率是$\frac{{m}_{2}g}{\frac{{m}_{1}}{27}×78}$=$\frac{9{m}_{2}}{26{m}_{1}}$×100%,故答案为:$\frac{9{m}_{2}}{26{m}_{1}}$×100%.
点评 本题考查了离子反应方程式的书写、电解的原理制取氢氧化铝和一定物质的量浓度溶液的配制步骤以及用到的仪器,难度不大,注意实验的基本操作方法和注意事项.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .D的物质的名称是乙醛.
.D的物质的名称是乙醛.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

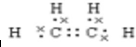 ,A分子内含有的官能团是(填名称)醛基.
,A分子内含有的官能团是(填名称)醛基.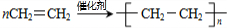 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷中混有的乙烯,可以用酸性KMnO4溶液洗气除去 | |
| B. | 乙烯、苯都易燃烧,燃烧时都产生明亮火焰、大量黑烟 | |
| C. | 乙酸乙酯、油脂都能水解,且在热的NaOH溶液中水解更完全 | |
| D. | 葡萄糖、淀粉都有还原性,都能与新制Cu(OH)2共热产生砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=Z-n | B. | 所含中子数=A-Z+n | ||
| C. | 质量数=A+n | D. | 所含电子数=Z+n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水应该盛放在棕色的广口瓶中 | |
| B. | 某溶液中加入CCl4后显紫色,证明溶液中有I- | |
| C. | 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 | |
| D. | 某溶液中滴加BaCl2溶液后有白色沉淀生成,加入稀盐酸后沉淀不消失,则该溶液中可能有Ag+或SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com