
【题目】要鉴别己烯中是否混有少量甲苯,正确的实验方法是( )
A. 先加足量的酸性高锰酸钾溶液,然后再加入溴水
B. 先加足量溴水,然后再加入酸性高锰酸钾溶液
C. 分别点燃这两种液体,观察现象
D. 加入浓硫酸与浓硝酸后加热
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质分类的正确组合为
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | 石灰水 | CH3COOH | CaF2 | SO3 | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是重要的化工原料.
(1)实验室常用NH4Cl和Ca(OH)2制备NH3 , 该反应的方程式为 . 反应发生装置、气体收集装置和尾气处理装置依次为 . 
(2)按图2装置(A、B两容器体积相等,温度相等)进行NH3性质实验.
①先打开旋塞1,B瓶中的现象是 , 原因是(用化学方程式表示),稳定后,关闭旋塞1.
②再打开旋塞2,B瓶中的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下:

已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤Ⅰ中的化学方程式_________;步骤Ⅱ中生成Al(OH)3的离子方程式___________。
(2)步骤Ⅲ,下列操作合理的是____________。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序_______________。
①迅速降至室温 ②用玻璃棒摩擦器壁 ③配制90℃的明矾饱和溶液 ④自然冷却至室温 ⑤选规则明矾小晶体并悬挂在溶液中央 ⑥配制高于室温10-20℃的明矾饱和溶液
(4)由溶液A制备AlCl3·6H2O的装置如下图:

①通入HCl的作用是抑制AlCl3水解和________________________。
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是_____;洗涤时,合适的洗涤剂是_____。
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol纯净物R完全燃烧消耗0.75 mol O2,只生成0.5 mol CO2、0.5 mol H2O和0.1 mol HCl,则R可能的结构有(不考虑立体异构) ( )
A. 6种 B. 8种 C. 10种 D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途不对应的是( )
A. 铝合金的密度小,硬度大,可用作建筑材料
B. 食品工业中用Na2CO3作焙制糕点的膨松剂
C. FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板
D. 明矾能生成Al(OH)3胶体,可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在容积为1.00L的容器中,通入一定量的N2O4发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①反应的△H_______0(填“大于”“小于”);
②100℃时,体系中各物质浓度随时间变化如右图所示。在0~60s时段,反应速率v(N2O4)为_________molL-1s-1反应的平衡常数K为__________。
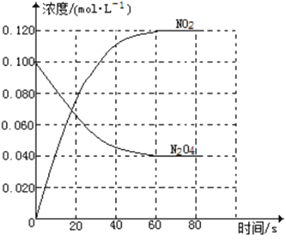
(2)在恒容密闭容器中通入X 并发生反应:2X(g) = Y(g);温度T1、T2下X的物质的最浓度c(X)随时间t 变化的曲线如图所示。
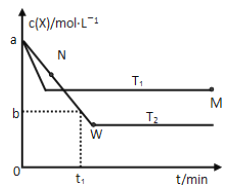
①T1____T2 (填“大于”或“小于”)。
②M点的正反应速率V正____N点的逆反应速率V逆(填“大于”,“小于”或“等于”)。
(3)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s) + Br2(g) ΔH= + 105. 4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会_______(填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Na+、SO42—、CO32—、HCO3—4种离子,若向其中加入少量过氧化钠固体后,溶液中离子浓度基本保持不变的是( )
A. HCO3— B. Na+ C. CO32— D. SO42—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com