
| A、常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
| B、用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
| C、BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 |
| D、为准确测定盐酸与氢氧化钠溶液反应的中和热,所用酸和碱的物质的量应相等 |


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
| A、最终得到的溶液中:C(Na+)=C(Cl-)+C(OH-) |
| B、反应过程中得到标准状况下气体的体积为7.84L |
| C、最终得到C(Na+)=1.5mol/L |
| D、最终得到沉淀为Al(OH)3,质量是7.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 578 | 1817 | 2745 | 11575 |
| A、元素X的常见化合价是+1 |
| B、元素Y是ⅢA族元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、若元素Y处于第3周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统 |
| B、含磷洗衣粉中的磷是植物生长的营养元素,洗衣水可排入河泊 |
| C、在入海口的钢铁闸门上装一定数量的锌块可防止闸门被腐蚀 |
| D、国家规定商家不得无偿提供塑料袋,是为了减少白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将25g CuSO4?5H2O溶于100 mL蒸馏水中,配制100mol l.0 mol/LCuSO4溶液 |
| B、检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的气体 |
| C、用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 |
| D、用银氨溶液鉴别葡萄糖和蔗糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线.请分析讨论以下问题.
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线.请分析讨论以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:
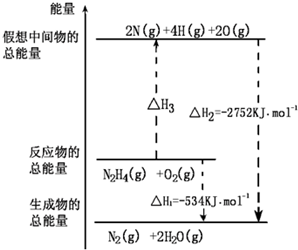 肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图,已知断裂1mol化学键所需的能量(kJ):N≡N为942、N-H为391、O=O为500,则断裂1molN-N键所需的能量(kJ)是( )
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图,已知断裂1mol化学键所需的能量(kJ):N≡N为942、N-H为391、O=O为500,则断裂1molN-N键所需的能量(kJ)是( )| A、1327 | B、391 |
| C、516 | D、154 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com