
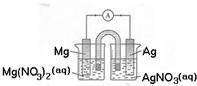
 某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理.请完成下列问题:
某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理.请完成下列问题:分析 (1)Mg、Ag、硝酸银构成的原电池中,Mg失电子作负极;
(2)电子从负极流向正极;
(3)取出盐桥时不能形成闭合回路;
(4)根据电极反应中Mg与电子的关系计算Mg的质量;
(5)活性电极作阳极时,电极失电子生成金属阳离子,阴极上溶液中的阳离子得电子.
解答 解:(1)Mg、Ag、硝酸银构成的原电池中,Mg失电子作负极,负极反应为:Mg-2e-=Mg2+;
故答案为:Mg-2e-=Mg2+;
(2)原电池中,电子从负极流向正极,Mg为负极,Ag为正极,则电子从Mg经由导线流向Ag;
故答案为:从Mg经由导线流向Ag;
(3)取出盐桥时不能形成闭合回路,不满足原电池的构成条件,不能形成原电池,所以没有电流通过,电流表不偏转;
故答案为:不;
(4)Mg电极上的电极方程式为Mg-2e-=Mg2+,则电路中每转移2mol电子,消耗1molMg,即Mg减少的质量为24g;
故答案为:24;
(5)使Ag与盐酸反应生成氢气,需要把活性电极Ag作阳极,Ag失电子生成阴离子,石墨为阴极,阴极上溶液中的阳离子得电子,即氢离子得电子生成氢气,其电解总反应为:2Ag+2HCl=2AgCl+H2↑;
答:Ag作阳极,石墨为阴极,HCl溶液为电解质溶液,通电电解.
点评 本题考查原电池和电解池有关知识,侧重于学生分析能力和基本理论的理解和运用的考查,注意把握金属的活泼性强弱以及电极方程式的书写,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4Cl2有三种同分异构体 | |
| B. | 将苯与浓硝酸和浓硫酸共热制取硝基苯 | |
| C. | 将红热的铜丝迅速插入无水乙醇中可将乙醇氧化为乙醛 | |
| D. | 可用浓硝酸鉴别淀粉溶液和鸡蛋白溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡逆向移动 | C. | A的转化率降低 | D. | C的体积分数升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏均属化学变化 | |
| B. | 乙烯和苯都能使溴水褪色,褪色原理相同 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油可作护肤保湿剂 | |
| B. | 无水氯化钙可用作食品干燥剂 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com