
分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体总物质的量,再根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算混合气体平均相对分子质量.
解答 解:标准状况下,甲烷和一氧化碳的混合气体共8.96L,物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,混合气体质量为7.6g,则平均摩尔质量为$\frac{7.6g}{0.4mol}$=19g/mol,则混合气体平均相对分子质量为19,
故答案为:19.
点评 本题考查物质的量有关计算,比较基础,熟练掌握物质的量之间的有关计算,注意掌握相对分子质量计算方法.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀铜,表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 铁丝与浓硫酸在常温下钝化 | |
| D. | 在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
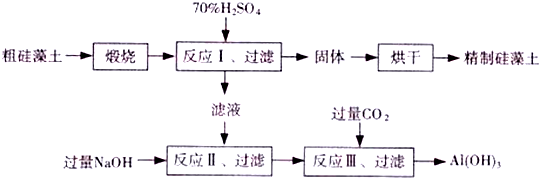
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
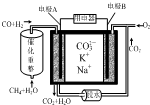
| A. | 电极A为正极,发生了还原反应 | |
| B. | 电极A上CO参与的电极反应为:CO+O2--2e-═CO2 | |
| C. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- | |
| D. | 电池工作时,K+向电极A移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
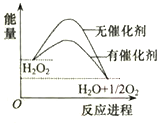
| A. | 元素O的单质存在O2和O3两种同位素 | |
| B. | 加入催化剂,减小了H2O2分解反应的热效应 | |
| C. | 若H2O2分解产生1molO2,理论上转移4mol电子 | |
| D. | H2O2和Na2O2所含化学键类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
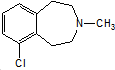 )一种治疗心血管和高血压的药物,可由化合物B(
)一种治疗心血管和高血压的药物,可由化合物B( )通过以下路线合成:
)通过以下路线合成: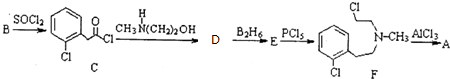
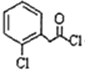 +CH3NH(CH2)2OH→
+CH3NH(CH2)2OH→ +HCl.
+HCl. .由F生成A的反应类型为取代反应.
.由F生成A的反应类型为取代反应. 或
或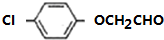 .
.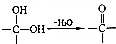 .写出以
.写出以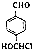 为原料制备化合物
为原料制备化合物 的合成路线流程图.
的合成路线流程图. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
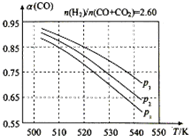 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com