
| A、z=4 | ||
| B、B物质的转化率是20% | ||
| C、A的平衡浓度是1.6 mol/L | ||
D、平衡时气体压强是原来的
|
| 1.6mol | ||
|
| 1.6mol | ||
|
| 0.8mol |
| 2mol |
| 2.8mol |
| 2L |
| 2.8mol+1.2mol+1.6mol+0.8mol |
| 4mol+2mol |
| 16 |
| 15 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱电解质 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| NH3?H2O | 1.8×10-5 |
| 难溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1.1×10-10 |
| BaCO3 | 2.6×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
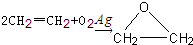
查看答案和解析>>
科目:高中化学 来源: 题型:
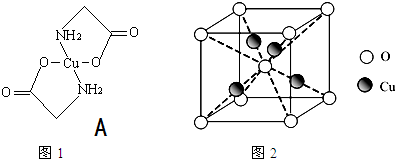
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| OH- | CO | Cl- | NO | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 不 | 溶 | 溶 |
| Ba2+ | 溶 | 不 | 溶 | 溶 |
| Mg2+ | 不 | 微 | 溶 | 溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500mL,40g |
| B、500mL,36g |
| C、450mL,36g |
| D、450mL,40g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com