
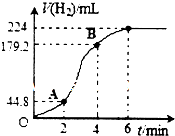
 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4) /mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 20 | 2滴CuSO4溶液 |
分析 影响锌与稀硫酸的反应速率的因素,除锌粉的颗粒大小、质量及纯度外,主要是浓度、温度及催化剂等因素;
(1)对相同的锌粉来说,稀硫酸的浓度越大,反应速率越快,温度越高反应速率越快,利用原电池原理也可以加快反应速率,锌完全消失所需的时间越短;
(2)1和2除固体表面积不同外,其它因素均相同;3比1多滴加了2滴CuSO4溶液;
(3)①分析相同时间内氢气体积的多少来判断速率的快慢;
②利用速率表达式v=$\frac{△c}{△t}$计算速率.
解答 解:(1)第5组实验时温度最高,浓度最大,也滴加了硫酸铜溶液,利用了Zn-Cu原电池,因此反应速率最快,锌完全消失所需的时间最短,
故答案为:锌完全消失所需的时间;5;
(2)1和2除固体表面积不同外,其它因素相同,是考查固体反应物的表面积对速率的影响,实验3比1多了形成Zn-Cu原电池,因此考查影响速率的因素是否形成原电池,
故答案为:固体反应物的表面积;是否形成原电池;
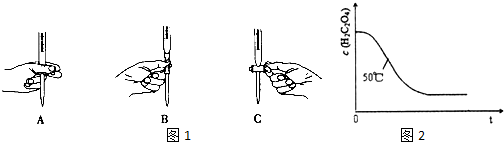
(3)①从图中看出2-4分钟内产生氢气最多,故这段时间内反应速率最大,因为为反应放热,使温度升高,反应速率加快,
故答案为:AB;反应放热,使温度升高,反应速率加快;
②2-4分钟内,产生氢气179.2-44.8=134.4mL,物质的量为$\frac{134.4×1{0}^{-3}L}{22.4L•mo{l}^{-1}}$=6×10-3mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量为:6×10-3mol,v(H2SO4)=$\frac{△c}{△t}$=$\frac{6×1{0}^{-3}mol}{0.05L×2min}$=0.06mol•L-1•min-1,故答案为:0.06mol•L-1•min-1.
点评 本题考查了反应速率的测定及影响因素,中等难度,注意在比较外界反应条件对反应速率的影响时,要限定其他条件相同,改变一个条件,这是解题的依据.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | -2 | +2 | +1 | +5,-3 | +7,-1 | +1 | +5,-3 | +3 |
| A. | ⑧号元素为Al | |
| B. | 上述八种元素最高价氧化物对应的水化物⑤号酸性最强 | |
| C. | ②、③处于同一周期 | |
| D. | ④元素的气态氢化物沸点大干⑦元素的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)<c(Cu2+)<c(H+)<c(SO42-) | B. | c(OH-)<c(H+)<c(SO42-)<c(Cu2+) | ||
| C. | c(OH-)<c(H+)<c(SO42-)=c(Cu2+) | D. | c(OH-)<c(H+)<c(Cu2+)<c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠、碳化钙着火时,可直接用高压水枪喷火扑灭 | |
| B. | 去除银器表面的Ag2S,可将银器放在盛有食醋的铝锅中煮沸 | |
| C. | 苹果在空气中久置变黄和纸张变黄的原理相似 | |
| D. | 用乙醚从黄花蒿中萃取青蒿素发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
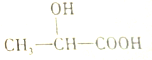
| A. | 1mol乳酸可以与足量的NaHCO3反应生成1molCO2 | |
| B. | 1mol乳酸可以与足量的钠反应生成1mol氢气 | |
| C. | 乳酸可以在一定条件下发生消去反应生成CH2=CHCOOH | |
| D. | 乳酸可以与NaOH溶液反应生成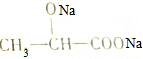 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:| 编号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解 的时间/s |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 细小颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响; b.实验1和3探究反应物浓度对该反应速率的影响; c.实验1和4探究催化剂对该反应速率的影响. | |
| 体积 (mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3过量 | |
| B. | AlCl3的量恰好与氢氧化钠完全反应 | |
| C. | 两种碱均过量 | |
| D. | AlCl3的量恰好与氨水完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com