

分析 如果A是淡黄色固体,A与氧气反应生成C,则A为S,C为SO2,根据题中转化关系,A与氢气反应生成B为H2S,C与氧气反应生成D为SO3,D与水反应生成E为H2SO4,浓硫酸与铜加热条件下反应生成二氧化硫,符合转化关系;
如果A是无色气体,根据题中转化关系,A能与氢气也能和氧反应,则A应为N2,B为NH3,C为NO,D为NO2,E为HNO3,铜与稀硝酸反应生成一氧化氮,符合转化关系,据此进行答题.
解答 解:(1)如果A是淡黄色固体,A与氧气反应生成C,则A为S,C为SO2,根据题中转化关系,A与氢气反应生成B为H2S,C与氧气反应生成的D为SO3,D与水反应生成E为H2SO4,浓硫酸与铜加热条件下反应生成二氧化硫,E→C的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
故答案为:SO2;H2SO4;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(2)如果A是无色气体,根据题中转化关系,A能与氢气也能和氧反应,则A应为N2,B为NH3,C为NO,D为NO2,E为HNO3,铜与稀硝酸反应生成一氧化氮,符合转化关系,E→C的反应为铜与稀硝酸反应生成硝酸铜、NO气体和水,反应化学方程式为:8HNO3+3Cu=3Cu(NO3)2+2NO↑+4H2O,
故答案为:8HNO3+3Cu=3Cu(NO3)2+2NO↑+4H2O.
点评 本题考查无机物的推断,题目难度中等,主要考查硫、氮的单质及其化合物知识,解题的关键是在审题的基础上找准解题的突破口,经过分析,归纳,推理,得出正确的答案.


科目:高中化学 来源:2016-2017学年四川省高一上第一次月考化学卷(解析版) 题型:实验题
对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热分解等。下列 各组混和物的分离或提纯应采用什么方法?
各组混和物的分离或提纯应采用什么方法?
①提取碘水中的碘,用_____________方法。
②除去食盐溶液中的水,可采用_____________的方法。
③淡化海水,可采用_____________的方法。
④氧化铜中含有铜绿[主要成分为碱式碳酸铜Cu2(OH)2CO3]可用________的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3 CH2 CH2CH3 | B. | (CH3)3C C(CH3)3 | ||
| C. | CH3CH(CH3)CH3 | D. | CH3C(CH3)2CH2 CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
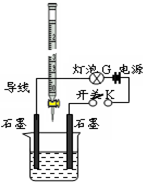 某温度下,水的离子积Kw=l×10-11.有pH=a的酸溶液A,pH=b的碱溶液B.某同学利用如图所示的实验装置,进行实验.
某温度下,水的离子积Kw=l×10-11.有pH=a的酸溶液A,pH=b的碱溶液B.某同学利用如图所示的实验装置,进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是 SiO2 | |
| B. | 石英玻璃常用来制耐高温的化学仪器 | |
| C. | 硅酸盐工业使用的每一种原料中都含有硅 | |
| D. | 水泥和普通玻璃都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
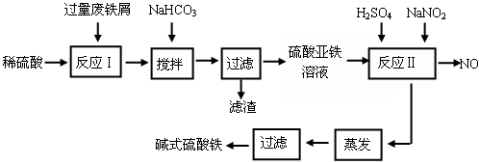
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com